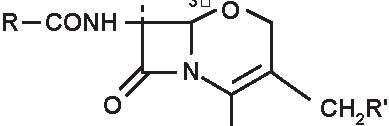
Beta-lattamine
Generalità
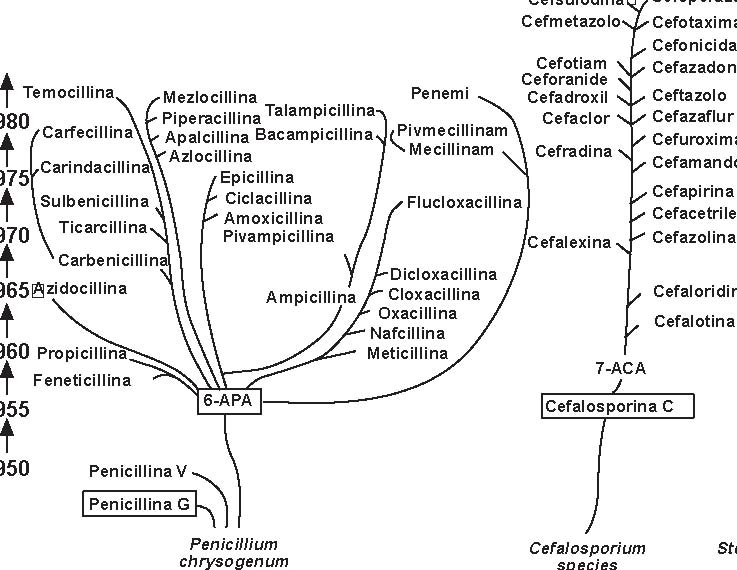
Quella delle beta-lattamine resta la famiglia di antibiotici più utilizzata, più diversificata e meno tossica. È sempre in evoluzione e nuovi prodotti compaiono praticamente di continuo. Dopo la scoperta della penicillina G nel 1942, si è assistito alla comparsa della prima penicillina estrattiva orale, la penicillina V; in seguito, da quando è stato ottenuto l’acido 6-aminopenicillanico (6-APA), il nucleo comune a tutte le penicilline, e l’acido 7-aminocefalosporanico (7-ACA), il nucleo comune a tutte le cefalosporine, si è potuto arrivare alla sintesi delle beta-lattamine semisintetiche: aminopenicilline, carbossipenicilline, ureidopenicilline, penicilline antistafilococciche, mecillinam, penemi e carbapenemi (inibitori irreversibili delle beta-lattamasi), così come alla comparsa delle cefalosporine di prima, seconda, terza e quarta generazione e dei monobattamici (Figura 3.1).
Classificazione
Le beta-lattamine possono essere classificate in base a diversi criteri (vedere anche capitolo “Criteri di classificazione degli anti-infettivi”)
1) In base al modo con cui si ottengono, in base alla loro composizione chimica ed alla loro principale indicazione clinica:
a) Penicilline (penami) con più sottoclassi:
-penicilline estrattive: penicillina G e suoi sali ed esteri, penicillina V -penicilline anti-stafilococciche -aminopenicilline -carbossipenicilline e sulfossipenicilline -N-acil-penicilline ed acil-ureidopenicilline -amidinopenicilline -penemi -carbapenemi -inibitori delle beta-lattamasi: clavami, (ossapenami) o sulfopenicillinati (penami sulfonati)
b) Cefalosporine (cefemi), cefamicine, oxacefemi e carbacefemi c) Monobattami
2) In base al loro spettro d’azione si distinguono:
a) Beta-lattamine a spettro ristretto:
-penicilline antistafilococciche: cocchi Gram positivi -amdinocilline: alcuni enterobatteri -cefsulodine: Pseudomonas -temocillina: enterobatteri -monobattami: bacilli Gram negativi: enterobatteri, Pseudomonas
b) Beta-lattamine a spettro antibatterico medio:
-penicillina G e suoi analoghi: cocchi Gram positivi e Gram negativi, bacilli Gram positivi, anaerobi Gram positivi, leptospire, Treponema -cefalosporine di prima e seconda generazione: cocchi Gram positivi e Gram negativi, bacilli Gram positivi, alcuni enterobatteri -aminopenicilline: cocchi Gram positivi e Gram negativi, bacilli Gram positivi, alcuni enterobatteri
c) Beta-lattamine a largo spettro antibatterico:
enterobatteri, cocchi Gram positivi e Gram negativi, anaerobi Gram positivi e Gram negativi: -carbossi- ed ureidopenicilline VADEMECUM DEGLI ANTIBIOTICI
1. 6-APA 2. Penami 3. Penemi
![]()
![]() SR2
R6
SR2
R6
![]() SR2
H
SR2
H
S
CH3 R6
N CHCH ![]()
![]() C
C
![]() B
B
![]() COOH
COOH
N A CH![]() CH3
ON COO
CH3
ON COO
![]() ON
ON
O COOH
A= Anello tiazolidinico
B= Anello β -lattamico
4. Carbapenemi 5. Clavami
![]() C
R2
C
R2 ![]() O
CH-CH2OH R6
O
CH-CH2OH R6
NN O COO O COOH
Figura 3.1 Derivati dell’acido 6-amino-penicillanico (6-APA).
-aminopenicilline + inibitori delle beta-lattamasi-cefalosporine di terza e quarta generazione
d) Beta-lattamine a spettro antibatterico molto largo:
enterobatteri, Pseudomonas-Acinetobacter, cocchi e bacilli
Gram positivi, compreso l’enterococco, cocchi Gramnegativi, anaerobi Gram
positivi e Gram negativi; carbapenemi, alcuni penemi.
3) In base alla loro carica ionica le beta-lattamine si dividono in:
a) monoanioniche: cefalotina, cefazolina, cefacetrile, cefamandolo, ceftizoxima, cefoxitina, cefmetazolo, cefuroxima,
cefoperazone, ureidopenicilline b) dianioniche: aztreonam, ceftriaxone, latamoxef, carbossipenicilline c) zwitterioni: ampicillina, cefalexina, cefaclor, cefaloridina, cefradina, cefepima. d) aventi una carica positiva e due cariche negative: cefsulodina, ceftazidime e, tra gli altri antibiotici, la teicoplanina. Tutte le beta-lattamine hanno in comune un certo numero di caratteristiche: -nucleo beta-lattamico; -modalità d’azione simile: per inibizione della sintesi della parete batterica; -azione battericida tempo-dipendente, eccetto che sugli enterococchi; -meccanismo comune di resistenza batterica; -assenza di attività sui germi privi di parete cellulare, a localizzazione intracellulare; -frequente sinergia con gli aminosidi; -assenza di tossicità; -effetto inoculo*, quando si tratta di specie batteriche che producono beta-lattamasi e di beta-lattamine idrolizzate
dalle beta-lattamasi. L’effetto inoculo è nullo o ridotto con le beta-lattamine resistenti alle beta-lattamasi: cefalotina, cefamicina, imipenem, monobattamici, così come per gli aminosidi, i fluorchinoloni, la fosfomicina, i nitroimidazolici; esso, invece, è importante con le beta-lattamine poco resistenti o idrolizzate dalle beta-lattamasi: cefamandolo, cefoperazone, cefaloridina, cefaclor, penicillina G, aminopenicilline, ureidopenicilline, cefalosporine di prima generazione amoxicillina/acido clavulanico; mentre, è più scarso con le carbossipenicilline che con le ureidopenicilline.
* Effetto inoculo: variazione dell’attività antibatterica (delle MIC) di un antibiotico in funzione dell’entità dell’inoculo (numero di germi messi a contatto con l’antibiotico in esame): -inoculo esiguo: 103-104 batteri -inoculo cospicuo: 106-107 batteri L’effetto inoculo è in rapporto: -al carattere omogeneo o eterogeneo della gamma delle MIC di una data popolazione batterica: le MIC sono più elevate in una
popolazione batterica eterogenea rispetto a quelle di una popolazione batterica omogenea; -alla capacità di produzione di beta-lattamasi da parte dei batteri: più essa è marcata, più l’effetto inoculo è importante (Staph. aureus, H. influenzae, Neisseria, Moraxella catarrhalis, Pseudomonas);
-all’antibiotico: gli antibiotici privi o con un effetto inoculo molto debole (imipenem, cefamicina, aztreonam), richiedono dei tassi sierici meno elevati per raggiungere le MIC rispetto agli antibiotici con un effetto inoculo importante (esempio ureidopenicilline).
4) In base alla capacità di induzione della beta-lattamasi, le beta-lattamine possono essere classificate in 2 categorie:
a) beta-lattamine potenti induttrici delle cefalosporinasi cromosomiche di classe I di alcuni bacilli Gram negativi (Enterobacter, Citrobacter, Serratia, Proteus indolo-positivo, Pseudomonas).
Queste beta-lattamine induttrici possono essere distinte in ulteriori 2 categorie
-beta-lattamine potenti induttrici delle beta-lattamasi, ma allo stesso tempo molto sensibili alle beta-lattamasi da esse indotte: penicilline G e V, aminopenicilline, la maggior parte delle cefalosporine di prima generazione, e cefamandolo (i batteri precedentemente citati sono resistenti a tali beta-lattamine);
-beta-lattamine potenti induttrici delle cefalosporinasi di classe I, ma allo stesso tempo stabili alle beta-lattamasi indotte: cefamicine, latamoxef, carbapenemi ed acido clavulanico. b) beta-lattamine deboli induttrici delle beta-lattamasi: cefalosporine di 3 e 4 generazione, carbossi ed
ureidopenicilline, amdinocillina, penicilline antistafilococciche, monobattamici, sulbactam e tazobactam. L’induzione delle beta-lattamasi è alla base dell’antagonismo osservato con i bacilli Gram negativi citati quando si associano due beta-lattamine di cui una potente induttrice delle beta-lattamasi (carbapenemi, cefamicine) e l’altra scarsamente induttrice delle beta-lattamasi (cefalosporine di 3a generazione, ureidopenicilline). Tuttavia, si posso-no associare due beta-lattamine deboli induttrici delle beta-lattamasi, ad esempio una penicillina antistafilococcica con una ureidopenicillina o con una cefalosporina di 3a generazione, oppure associare due beta-lattamine potenti induttrici delle beta-lattamasi, ad esempio amoxicillina + acido clavulanico.
5) In base alla resistenza o alla idrolisi da parte delle beta-lattamasi batteriche, le beta-lattamine si distinguono in (Tabella 3.1): a) beta-lattamine idrolizzate dalle beta-lattamasi plasmidiche comuni degli enterobatteri: penicilline G e V, aminopenicilline, carbossi- ed ureidopenicilline b) beta-lattamine non idrolizzate da queste beta-lattamasi: cefamicine, cefalosporine di 3a e 4a generazione, monobattamici, amoxicillina/ac. clavulanico, carbapenemi e penemi c) beta-lattamine non idrolizzate dalle beta-lattamasi plasmidiche a spettro allargato: cefamicine, carbapenemi, penemi, latamoxef, amoxicillina/ac. clavulanico.
d) beta-lattamine non idrolizzate dalle cefalosporinasi cromosomiche inducibili di classe I dei mutanti derepressi stabili di certi bacilli Gram negativi: carbapenemi, penemi e) beta-lattamine non idrolizzate dalle beta-lattamasi inducibili dei batteri Gram positivi: penicilline antistafilococ-ciche, cefalosporine, amoxicillina/ac. clavulanico. f) beta-lattamine non idrolizzate dalle cefalosporinasi cromosomiche dei Bacteroides: amoxicillina/ac. clavulanico, carbapenemi, penemi.
Composizione chimica ed origine
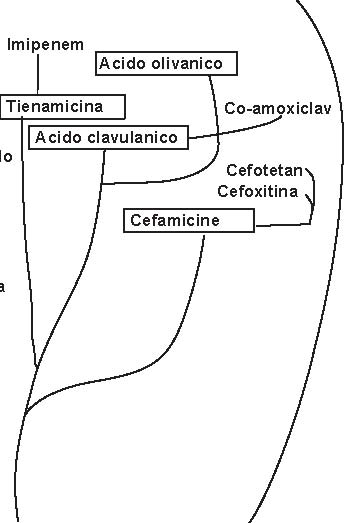
Le beta-lattamine attuali si ottengono da (Figura 3.2): -Penicillium chrysogenum: penicilline -Cefalosporium: cefalosporine -Streptomyces: cefamicine, tienamicine, acido clavulanico, acidi olivanici -da batteri: monobattamici Tutte le beta-lattamine attuali, ad eccezione della penicillina G e della penicillina V (penicilline estrattive), si otten-gono per semisintesi a partire dall’acido 6-APA, per le penicilline, e dall’acido 7-ACA per le cefalosporine. I monobattami si ottengono attualmente per sintesi chimica totale. Il dosaggio delle penicilline estrattive (G, V) si esprime sempre in unità internazionali (U.I.): 1 U.I.=0.6 µg di penicil-lina G. Tutte le beta-lattamine (penicilline, cefalosporine) presentano una configurazione “cis” ad eccezione dei carbape-nemi (imipenem), che presentano una configurazione “trans”.
Meccanismo d’azione
Tutte le beta-lattamine esplicano un’azione battericida dovuta all’inibizione della sintesi del peptidoglicano della parete batterica. Tuttavia, sul piano morfologico, l’effetto delle diverse beta-lattamine (a bassissime concentrazioni, inferiori alla MIC dei microrganismi) è differente: alcune provocano dapprima la formazione di forme filamentose e quindi una lisi batterica più tardiva (per esempio le cefalosporine), altre determinano la formazione di sferoplasti con lisi batterica precoce (esempio penicillina G), altre ancora provocano la comparsa di forme rotondeggianti, globose ed una lisi batterica più tardiva (esempio amdinocilline). Questi diversi effetti morfologici corrispondono ad una differenVADEMECUM DEGLI ANTIBIOTICI
Cefsulodina Cefoperazone Monobattami Cefotaxima
Cefazadone
1980 Cefuroxima Cefamandolo 1975
1970
1965 Cefaloridina
1960 1955
Cefalosporium species
Steptomyces Batteri species
Microorganismi
Figura 3.2 Sviluppo delle beta-lattamine e degli inibitori delle beta-lattamasi (i prodotti naturali sono inseriti nei riquadri). (Tratta da: Rolinson G.N., modificata).
te fissazione preferenziale delle beta-lattamine su specifici bersagli (recettori) batterici, costituiti dalle proteine di membrana PBP (penicillin binding proteins). Esse, scoperte da Spratt nel 1975 su un mutante di E. coli non produttore di beta-lattamasi, sono in realtà degli enzimi: (transpeptidasi, carbossipeptidasi), situati sulla parte interna (citoplasmatica) della parete batterica, che intervengono nella sintesi del peptidoglicano della parete cellulare. Il numero delle PBP varia a seconda delle specie batteriche: per l’E. coli, che è stato il modello batterico più studiato, esistono 6 PBP che fissano le beta-lattamine in modo irreversibile con legame covalente. Esse sono identificate con i numeri 1a, 1b, 2, 3, 4, 5 e 6. Le PBP 1, 2 e 3 sono delle transpeptidasi essenziali per la vitalità della cellula batterica. Per altre specie batteriche il numero delle PBP è differente: 7 per Pseudomonas aeruginosa, 8 per H. influenzae, 4 per stafilococchi e streptococchi, 3 per Neisseria gonorrhoeae. Le PBP 4, 5 e 6 sono delle carbossipeptidasi la loro fissazione da parte delle beta-lattamine non si traduce in una modifica morfologica. Tutte le PBP sono enzimi polipeptidici (transpeptidasi, carbossipeptidasi, endopeptidasi) che hanno un peso moleco-lare progressivamente decrescente da 100000 a 40000 (Tabella 3.2). A concentrazioni molto basse di beta-lattamine (inferiori alla MIC dei batteri) si ha la fissazione alla PBP per la quale l’affinità della stessa è più forte. Se si aumenta la concentrazione della beta-lattamina, altre PBP vengono fissate (effetto morfologico concentrazione dipendente). Tuttavia, esistono beta-lattamine che si legano esclusiva-mente ad una sola PBP, per esempio il mecillinam alla PBP 2, l’aztreonam alla PBP 3. Per la maggior parte delle beta-lattamine la fissazione è più ampia pur esistendo un’affinità massima per una sola PBP, per esempio: -la penicillina G e l’amoxicillina hanno maggiore affinità per la PBP 1b ma, con l’aumentare della concentrazione,
si legano anche alla PBP 3 con formazione di sferoplasti e lisi batterica rapida; -l’imipenem lega le PBP 2 e 1b; -l’ampicillina, le cefalosporine, i monobattamici hanno più affinità per la PBP 3, con formazione di forme filamen
tose senza sepimentazione. Questa fissazione porta all’arresto della sintesi del peptidoglicano e quindi della crescita batterica, il che corrispon-de all’effetto batteriostatico delle beta-lattamine. L’effetto battericida è dovuto alla liberazione delle autolisine, per “relargage” degli acidi lipoteicoici, inibitori delle autolisine, che permettono alla mureina idrolasi di idrolizzare la mureina e di provocare la rottura della cellula batterica. È probabile che il bersaglio specifico per l’attivazione delle autolisine sia la PBP 1. I germi che non posseggono autolisine sono inibiti dagli antibiotici, ma non uccisi (fenomeno della tolleranza). Le PBP 2 sono molto meno numerose delle altre PBP nelle cellule batteriche. La modalità d’azione delle beta-lattamine (inibizione della sintesi della parete batterica) spiega la loro inefficacia sui batteri non muniti di parete e su quelli a localizzazione intracellulare: Chlamidya, Mycoplasma, Rickettsia.
BETA-LATTAMINE
L’effetto antibatterico delle beta-lattamine è anche influenzato dal pH: un pH molto acido aumenta le MIC, soprat-tutto per l’imipenem, la cefoxitina (anaerobi), ma molto di meno per le ureidopenicilline.La modifica per mutazione di alcune PBP comporta una diminuzione o perdita dell’affinità della beta-lattamina peruna o più PBP oppure la comparsa di una nuova PBP ad affinità molto bassa per la beta-lattamina: PBP 2a per lostafilococco, PBP 1c per lo pneumococco (resistenza da perdita di affinità del bersaglio per le beta-lattamine).Le beta-lattamine non presentano effetto post-antibiotico (PAE) sui bacilli Gram negativi.
Resistenze batteriche
Le resistenze batteriche alle beta-lattamine riconoscono molteplici meccanismi:
A)l’inattivazione enzimatica per idrolisi da produzione di beta-lattamasi è di gran lunga il meccanismo più frequen-te. Questo si riscontra soprattutto con certi germi: stafilococchi, Neisseria, Haemophilus, Moraxella catarrhalis, enterobatteri;
B)l’impossibilità di accesso della beta-lattamina alle PBP per modificazione o impermeabilità delle porine di mem-brana (una sorta di canali acquosi attraverso cui si realizza il passaggio delle beta-lattamine e di altri antibiotici nella cellula batterica), soprattutto le porine OmpF ed OmpC (per i batteri Gram negativi). Le specie batteriche (esclusivamente Gram negativi) che presentano dei mutanti per le porine sono resistenti a tutte le beta-lattamine, ad eccezione dell’imipenem;
C)alterazioni quantitative e qualitative del bersaglio (le PBP) alcuni mutanti possono giungere alla sostituzione della PBP bersaglio per acquisizione di un’altra PBP o per perdita dell’affinità delle PBP per le beta-lattamine;
D)l’inattivazione ad opera delle beta-lattamasi, per idrolisi del legame aminico a livello del loro nucleo beta-lattamico, comporta la perdita dell’attività antibatterica delle beta-lattamine per trasformazione in acido penicillanico o cefalosporanico, inattivi.
Vengono identificate di continuo le beta-lattamasi prodotte da batteri Gram positivi e Gram negativi, compresi
Legionella, Mycobacteria, Streptomyces.
Le beta-lattamasi si distinguono in base ad alcune diverse caratteristiche:
1) Secondo la loro localizzazione genetica: origine cromosomica o extracromosomica (Tabella 3.3, 3.4 e 3.5):
a) beta-lattamasi extracromosomiche per plasmidi o trasposoni, che permettono il trasferimento della resistenza da una specie batterica all’altra: TEM, SHV, OXA, PSE, penicillinasi stafilococciche, beta-lattamasi a spettro allargato degli enterobatteri
b) beta-lattamasi cromosomiche, indotte o depresse: penicillinasi, cefalosporinasi, oxy-iminocefalosporinasi.
Lo stesso batterio può essere munito di beta-lattamasi plasmidiche o cromosomiche.
2) Secondo il loro substrato preferenziale: penicilline (penicillinasi), cefalosporine (cefalosporinasi) o beta-lattamasi a largo spettro antibatterico (penicillinasi e cefalosporinasi)
3) In base alla loro sensibilità o resistenza alle beta-lattamine. In virtù di quest’ultimo criterio le beta-lattamine possono essere classificate in: -beta-lattamine idrolizzate dalle beta-lattamasi plasmidiche: penicillina G, aminopenicilline, carbossi- ed ureidopenicilline -beta-lattamine non idrolizzate dalle comuni beta-lattamasi plasmidiche degli enterobatteri: cefalosporine di 3a generazione, cefamicine, monobattamici, carbapenemi, amoxicillina/ac. clavulanico -beta-lattamine non idrolizzate dalle beta-lattamasi a spettro antibatterico allargato: cefamicine, imipenem, latamoxef, temocillina, acido clavulanico + aminopenicilline -beta-lattamine non idrolizzate dalle beta-lattamasi cromosomiche costitutive dei mutanti attivati stabili: imipenem -beta-lattamine idrolizzate solo dalle beta-lattamasi cromosomiche di Pseudomonas maltophilia, Bacteroides fragilis: imipenem -beta-lattamine non idrolizzate dalle penicillinasi inducibili dei batteri Gram positivi: penicilline antistafilococciche, amoxicillina/ac. clavulanico, cefalosporine
Le beta-lattamasi plasmidiche dei batteri Gram negativi sono costitutive.
Le beta-lattamasi plasmidiche dei batteri Gram positivi sono inducibili, trasferite per trasduzione o coniugazione
(batteriofagi). Le cefalosporinasi cromosomiche di classe I sono anch’esse inducibili.
Contrariamente alle beta-lattamasi dei bacilli Gram negativi, che restano localizzate nello spazio periplasmatico
dietro la membrana esterna dei batteri, le beta-lattamasi dei batteri Gram positivi (stafilococchi, Clostridium) sono
escrete nell’ambiente extracellulare (esoenzimi). Si tratta soprattutto di penicillinasi, più spesso inducibili, secrete
principalmente dagli stafilococchi e portate dai plasmidi. Le beta-lattamine idrolizzate da queste beta-lattamasi
sono la penicillina G, le aminopenicilline, le carbossi- ed ureidopenicilline, mentre le penicilline antistafilococciche
e la maggior parte delle cefalosporine sono stabili alle penicillinasi stafilococciche.
Le beta-lattamasi di Nocardia e dei micobatteri idrolizzano a loro volta penicilline e cefalosporine.
I batteri Gram positivi, essendo sprovvisti di membrana esterna, devono secernere quantità maggiori di beta-latta-masi per sfuggire alla lisi, mentre per i batteri Gram negativi piccole quantità di beta-lattamasi sono sufficienti a garantire la resistenza batterica. Quest’ultimo fenomeno è ulteriormente favorito dalla penetrazione lenta di certe beta-lattamine attraverso le porine di membrana. Per i batteri Gram positivi il livello di resistenza è in relazione alla densità della popolazione batterica: più essa è elevata, più la quantità di beta-lattamasi è alta e tanto maggiore è la resistenza batterica. Le beta-lattamasi liberate all’esterno delle cellule batteriche da certi germi (stafilococchi, H. influenzae, Moraxella catarrhalis, Bacteroides), presenti nello stesso soggetto ma non responsabili dell’infezione trattata, sono all’origine della cosiddetta patologia “indiretta” e responsabili di certi casi di mancata sterilizzazione batteriologica da parte delle beta-lattamine idrolizzabili, penicillina G e V e aminopenicilline da sole, a causa della loro inattivazione ad opera delle beta-lattamasi della flora commensale suddetta. Per i batteri anaerobi, le beta-lattamasi sono costituite sia da penicillinasi (Clostridium, Fusobacterium) sia, per la maggior parte, da cefalosporinasi cromosomiche e costitutive (Bacteroides). Le penicillinasi (classe 2, classe 3, classe 5) idrolizzano preferenzialmente le penicilline ad eccezione dell’associazio-ne aminopenicillina (o carbossipenicillina o ureidopenicillina) + inibitore delle beta-lattamasi. Le cefalosporinasi (classe 1, classe 6) idrolizzano preferenzialmente cefalosporine di prima generazione e, in minor misura, le aminopenicilline, le ureidopenicilline e le associazioni con un inibitore delle beta-lattamasi, ma non le carbossipenicilline. I batteri Gram negativi producono una maggiore varietà di beta-lattamasi (più di 30) rispetto ai Gram positivi. Esse sono più eterogenee sul piano genetico. In un gran numero di bacilli Gram negativi le cefalosporinasi cromosomiche di classe I sono prodotte in minore quantità e la loro regolazione è sotto il controllo negativo di un repressore. Nei mutanti attivi stabili selezionati dalle beta-lattamine, si ha una iperproduzione permanente di cefalosporinasi atti-vate di classe I che si accumulano nello spazio periplasmatico della cellula batterica a causa dell’inattivazione del repressore. Questa iperproduzione è indipendente dalla presenza della beta-lattamina, che non fa altro che selezio-nare questi mutanti preesistenti (modificazione genotipica). Tali mutanti derepressi stabili presentano una resisten-za crociata a tutte le beta-lattamine, comprese le cefalosporine di 3a generazione, ad eccezione dell’imipenem. Il dato più recente riguardo le resistenze batteriche attraverso l’idrolisi operata dalle beta-lattamasi plasmidiche è la resistenza acquisita alle cefalosporine di 3a generazione ed ai monobattami, soprattutto presso i servizi di riani-mazione medico-chirurgica. La maggioranza dei ceppi produttori di beta-lattamasi plasmidiche a spettro allargato (tipo III, classificazione di Richmond-Sykes) appartengono soprattutto a Klebsiella pneumoniae, specie fino ad ora molto sensibile alle cefalo-sporine. Questa resistenza è plasmidica e non inducibile e può, quindi, essere trasmessa ad altri enterobatteri. Di recente sono state isolate delle cefotaximasi (metossi-imino-cefalosporinasi): CTX-1 o TEM-3, SHV-2, SHV-4, ma soprattutto delle ceftazidimasi: TEM-7, CAZ-1, CAZ-2, SHV-4; SHV-5 (alcune delle quali conferiscono anche resi-stenza all’aztreonam), derivate da una beta-lattamasi TEM-2. Queste nuove beta-lattamasi idrolizzano tutte le beta-lattamine, ad eccezione delle cefamicine, dell’imipenem e del latamoxef. Ricordiamo che vi sono delle beta-lattamine che si comportano allo stesso tempo anche come inibitori delle beta-lattamasi (latamoxef, aztreonam). Gli inibitori attuali delle beta-lattamasi (acido clavulanico, sulbactam, etc) inibiscono la maggior parte delle beta-lattamasi plasmidiche, comprese le nuove beta-lattamasi a spettro antibatterico allargato, ma non le cefalosporinasi di classe 1. La ricerca delle beta-lattamasi è facile per certi germi, dove questi enzimi diffondono rapidamente attraverso la parete batterica. Esistono delle tecniche rapide per evidenziarle, che possono sostituire l’antibiogramma. È indispensabile ricercarle per H. influenzae, gonococchi, stafilococchi, produttori di penicillinasi, così come per K. pneumoniae. Per contro, la ricerca delle beta-lattamasi è più indaginosa quando trattasi di enterobatteri e di Pseudomonas in quanto questi, trovandosi nello spazio periplasmatico, non diffondono che lentamente attraverso la parete, per cui, per poterle evidenziare, è necessario distruggere la parte batterica con gli ultrasuoni. In base alla capacità di induzione delle beta-lattamasi, le beta-lattamine possono essere classificate in due categorie: 1) beta-lattamine potenti induttrici delle beta-lattamasi (cefalosporinasi cromosomiche di classe I prodotte da
enterobatteri, Citrobacter, Serratia, Proteus indolo-positivo, Pseudomonas). Queste beta-lattamasi non sono ini-
bite dagli attuali inibitori delle beta-lattamasi (acido clavulanico, etc).
Le beta-lattamine induttrici possono essere ulteriormente distinte in due categorie: a) beta-lattamine potenti induttrici delle beta-lattamasi, ma allo stesso tempo molto labili alle beta-lattamasi da
esse indotte (in virtù di questo fatto i batteri citati sono resistenti a queste beta-lattamine) penicillina G,
aminopenicilline, la maggior parte delle cefalosporine di 1a generazione, cefamandolo; b) beta-lattamine potenti induttrici delle beta-lattamasi (cefalosporinasi di classe II), ma allo stesso tempo stabili
alle beta-lattamasi da esse indotte: cefamicine, latamoxef, imipenem, acido clavulanico.
Il risultato finale dell’induzione delle cefalosporinasi iperprodotte di classe I è la selezione di germi resistenti a BETA-LATTAMINE
tutte le beta-lattamine, ad eccezione del mecillinam, della temocillina e dei carbapenemi. Questa resistenza indotta compare precocemente nel corso del trattamento.
2) beta-lattamine deboli induttrici della beta-lattamasi: cefalosporine di 3a generazione, carbossipenicilline e ureidopenicilline, amdinocilline, penicilline antistafilococciche, temocillina, monobactam, sulbactam, tazobactam. Paradossalmente, le beta-lattamine deboli induttrici delle beta-lattamasi e sensibili all’idrolisi operata da queste ultime, si comportano come selettori di mutanti batterici derepressi stabili, responsabili delle resistenze che compaiono nel corso del trattamento; invece le beta-lattamine fortemente induttrici delle beta-lattamasi (esem-pio: imipenem) non selezionano mutanti derepressi stabili e mantengono la loro attività su di essi (forse grazie al loro elevato potere di penetrazione attraverso le porine batteriche). Per contro, se il ceppo batterico è inducibile, il trattamento deve preferire una beta-lattamina debole induttrice delle beta-lattamasi, per esempio una carbossi- od una ureidopenicillina. L’induzione delle beta-lattamasi può essere evitata associando un aminoside o con un’associazione tra un inibi-tore delle beta-lattamasi ed una beta-lattamina labile alle beta-lattamasi. L’induzione delle beta-lattamasi spiega anche l’antagonismo osservato con certi germi (Enterobacter, Citrobacter, Pseudomonas), quando si associano due beta-lattamine, di cui una potente induttrice delle beta-lattamasi (cefamicina, imipenem) e l’altra debole induttrice, o potente induttrice, ma labile alle beta-lattamasi: per esem-pio ureidopenicilline, cefalosporine di 3a generazione. Si possono, tuttavia, associare due penicilline deboli induttrici delle beta-lattamasi, esempio penicillina antistafilococcica con una ureidopenicillina o con una cefalosporina di 3a generazione, oppure due beta-lattamine potenti induttrici delle beta-lattamasi, esempio amoxicillina + acido clavulanico. In base alla loro capacità di produzione di beta-lattamasi, i microrganismi batterici possono essere classificati in due categorie:
-batteri deboli produttori o non produttori di beta-lattamasi: E. coli, Proteus mirabilis, Shigella, Salmonella, strep-tococchi, Clostridium perfrigens, Peptostreptococchi;
-batteri forti produttori di beta-lattamasi, in relazione alla quantità di beta-lattamine presenti: Pseudomonas, Enterobacter, Citrobacter, Proteus indolo positivo, Providencia, Serratia, H. influenzae, Moraxella catarrhalis. In base alle beta-lattamasi secrete dai batteri, si possono distinguere:
-le penicillinasi inducibili degli stafilococchi;-le penicillinasi plasmidiche di Neisseria, H. influenzae, Branhamella (Moraxella) catarrhalis, Pseudomonas aerugi-
nosa, enterobatteri; -le beta-lattamasi a spettro allargato di certi enterobatteri: Klebsiella, E. coli; -le cefalosporinasi indotte da Enterobacter, Citrobacter, Serratia, Pseudomonas, o costitutive: come ad es.
Acinetobacter
-le cefalosporinasi dei mutanti iperproduttori degli stessi germi.
3) Resistenze batteriche per modifica o impermeabilità delle porine della membrana esterna dei batteri Gram nega-tivi. Queste si riscontrano soprattutto con lo Pseudomonas e enterobatteri, ma non con i batteri Gram negativi. La membrana esterna, tipica dei batteri Gram negativi, globalmente idrofoba, formata da fosfolipidi e da lipopo-lisaccaridi, costituisce una barriera di permeabilità per numerosi antibiotici, soprattutto lipofilici: macrolidi, aci-do fusidico. Per contro, per gli antibiotici idrofili come le beta-lattamine, la permeabilità della membrana esterna dei batteri dipende essenzialmente dalla composizione (quantità e stato funzionale) delle porine, proteine trans-membrana che formano dei canali che attraversano la membrana esterna. La resistenza batterica può essere dovuta, per esempio nell’E. coli, alla sostituzione della porina di membrana Omp F con Omp C o al non funziona-mento od all’assenza di una di queste due porine. Tra le beta-lattamine, quelle che posseggono una maggiore velocità di penetrazione attraverso le porine sono i carbapenemi, la cefaloridina e la cefalexina, cioè le beta-lattamine di piccole dimensioni, a struttura compatta e con carica neutra (zwitterioni). Per contro, le beta-lattamine dianioniche (- -) carbossipenicilline, ceftriaxone, aztreonam, sono beta-lattamine a penetrazione lenta attraverso i pori. Per lo Pseudomonas aeruginosa resistente all’imipenem, la resistenza batterica è dovuta alla mancata penetrazione delle beta-lattamine attraverso una particolare porina e non all’idrolisi da parte delle beta-lattamasi. Le beta-lattamine a rapida penetrazione sono meno interessate dall’aumento di produzione delle beta-lattamasi, perchè la velocità di penetrazione supera quella di idrolisi da parte delle beta-lattamasi.
4) Resistenza batterica per alterazione delle PBP. Si tratta di mutanti batterici muniti, a livello della membrana citoplasmatica, di PBP a ridotta affinità per le beta-lattamine o di PBP bersaglio sostituite con altre PBP. Questo tipo di resistenza è stata descritta soprattutto con i cocchi Gram positivi: stafilococchi meti-R, pneumococchi, enterococchi, e con Neisseria gonorrhoeae, H. influenzae, Pseudomonas aeruginosa.
L’esempio più conosciuto è quello degli stafilococchi meti-R (resistenza intrinseca, eterogenea, cioè solo una frazione della popolazione batterica esprime questa resistenza). Essa è dovuta alla comparsa, per induzione, di una PBP-2 A
che possiede una bassa affinità per le beta-lattamine. La sintesi della PBP-2 A è inibita dall’associazione dellafosfomicina con una beta-lattamina, associazione ad effetto sinergico sugli stafilococchi meti-R. Al momentoattuale la frequenza degli stafilococchi meti-R è di circa il 20% in ambiente ospedaliero e molto più rara in ambien-te extraospedaliero. Un altro esempio di resistenza per diminuzione dell’affinità per le PBP è quella degli pneumo-cocchi resistenti alla penicillina G, degli enterococchi e dell’E. faecium: PBP lenta (“slow reacting”).Le implicazioni della resistenza alle beta-lattamine per alterazione delle PBP sono:-a sensibilità ridotta di certi germi alle penicilline ed alle cefalosporine;-l’assenza di correlazione tra i test di sensibilità in vitro e l’attività in vivo delle beta-lattamine.Si tratta soprattutto del fenomeno della “tolleranza” di certi ceppi batterici alle beta-lattamine che si traduce nellascomparsa degli effetti battericidi di queste ultime con preservazione del loro effetto batteriostatico. Questo siesprime con un rapporto MBC/MIC > 32. La tolleranza può essere genetica o fenotipica ed è dovuta alla soppressio-ne od alla inibizione, per mutazione, degli enzimi autolitici dei batteri. Essa si osserva con i batteri Gram positivi:stafilococchi, streptococchi, pneumococchi, Listeria. Si può avere una tolleranza crociata tra beta-lattamine ed altriantibiotici battericidi interferenti con la biosintesi della parete cellulare: vancomicina, teicoplanina, fosfomicina.In caso di ceppi tolleranti, l’utilizzazione di associazioni di antibiotici battericidi è indispensabile.I batteri possono diventare resistenti grazie a molti meccanismi quali: effetti delle beta-lattamasi aumentati acausa della diminuzione della permeabilità delle porine che fanno in modo che anche piccole quantità di beta-lattamasi siano sufficienti a garantire una resistenza batterica.In questi ultimi anni si è documentata l’emergenza di resistenze ad alcune beta-lattamine (penicillina G,aminopenicilline), anche da parte di specie batteriche che fino ad oggi erano rimaste sensibili: pneumococchi,streptococchi, Pasteurella.Riassumendo, l’aumento recente delle resistenze batteriche alle beta-lattamine soprattutto in ambiente ospedalie-ro è dovuto principalmente:-all’estensione dell’attività delle beta-lattamasi plasmidiche di alcuni germi verso nuove beta-lattamine : cefalo-
sporine di 3a generazione, aztreonam, imipenem; -alle cefalosporinasi di classe I, indotte o prodotte da ceppi mutanti derepressi stabili di alcuni microrganismi,
iperproduttori di cefalosporinasi; -a mutazioni delle PBP. Gli sforzi per migliorare le beta-lattamine attuali sono diretti verso più direzioni: -ottenere beta-lattamine più resistenti all’idrolisi operata dalle beta-lattamasi cromosomiche o plasmidiche -ottenere delle beta-lattamine più capaci di penetrare attraverso le porine di membrana dei batteri Gram negativi -ottenere delle beta-lattamine con affinità aumentata per le PBP essenziali, -ottenere delle beta-lattamine con una migliore farmacocinetica e/o meno allergizzanti.
3.1 PENICILLINE
Generalità
Le penicilline propriamente dette e le cefalosporine rappresentano i due gruppi più importanti di beta-lattamine.
Classificazione
Si distinguono generalmente diverse sottoclassi di penicilline:
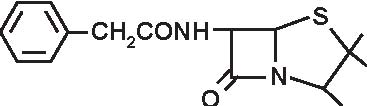
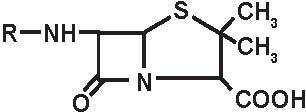
a) penicilline “naturali” estrattive: penicillina G con i suoi sali ed i suoi esteri, penicillina V (Figura 3.3).
b) penicilline semi-sintetiche, a partire dal 6-APA:
-penicilline antistafilococciche (Figura 3.4): isossazolilpenicilline: oxacillina e suoi derivati alogeni, alchilossipenicilline: meticillina, nafcilina;
-aminopenicilline (Figura 3.5), da sole od associate ad un inibitore delle beta-lattamasi, di struttura clavanica (acido clavulanico) o penemica (sulbactam, tazobactam)
-carbossipenicilline: carbenicillina, ticarcillina
-sulfossipenicilline (Figura 3.6): sulbenicillina
-N-acil-ureidopenicilline (Figura 3.7): apalcillina, azlocillina, furazlocillina, mezlocillina, piperacillina
-amdinopenicilline: (Figura 3.8) amdinocillina (mecillinam), pivmecillinam.
Un’altra classificazione è basata sulla loro stabilità o resistenza all’idrolisi ad opera delle beta-lattamasi:
a) penicilline resistenti all’idrolisi da parte delle beta-lattamasi: penicilline antistafilococciche, stabili alle penicillinasi dei cocchi Gram positivi: temocillina, stabile alle beta-lattamasi dei bacilli Gram negativi.
b) penicilline idrolizzate dalle beta-lattamasi: penicillina G e V, aminopenicilline, carbossi- ed ureidopenicilline, amdinocilline.
BETA-LATTAMINE
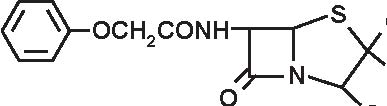
PENICILLINA G PENICILLINA V
 CH2CONH
S CH3
CH2CONH
S CH3
 OCH2CONH
S CH3 N CH3 N CH3OO
OCH2CONH
S CH3 N CH3 N CH3OO
COOH COOH
Figura 3.3 Struttura delle penicilline “naturali”.
![]() S
CH3
S
CH3
R-CONH CH3N
O COOH R
METICILLINA
OCH3
O CH3
Cl CLOXACILLINA
![]() ISOSSAZOLIL-PENICILLINE
ISOSSAZOLIL-PENICILLINE
![]() N
N
O CH3
Cl
DICLOXACILLINA
![]() N
Cl O CH3
N
Cl O CH3
F
FLUCLOXACILLINA
![]() N Cl
O CH3
N Cl
O CH3
NAFCILLINA
OC2H3
Figura 3.4 Struttura delle penicilline antistafilococciche.
 S
CH
S
CH
3
R-NH
CH
3
N
O COO-R' R R' O C-NH2 H
O CH-C-H NH2 O CH-C-H NH2
O O
![]() CH3
CH-C--CH2-O-C-C-CH
CH3
CH-C--CH2-O-C-C-CH![]() 3
3
![]() H2C
N CH3 O O
H2C
N CH3 O O
![]() CH3
CH-C--CH2-O-C-C-CH
CH3
CH-C--CH2-O-C-C-CH![]() 3
3
![]() NH2
CH3
NH2
CH3
OO CH-C--CH-O-C-CH2-CH3 ESTERI “PRO-FARMACI”
NH2 CH3
DELL’AMPICILLINA
![]() OO
OO
O CH-CNH2
CH-CO-O C
NH2-HCl
O
![]() O
-CH2-C=C-CH3 O HO
O
-CH2-C=C-CH3 O HO
![]() CH-C-H
NH2
CH-C-H
NH2
CICLACILLINA
AMPICILLINA
EPICILLINA
METAMPICILLINA
BACAMPICILLINA
TALAMPICILLINA
LENAMPICILLINA CLORIDRATO
Figura 3.5 Struttura delle aminopenicilline.
BETA-LATTAMINE
![]() CHCO
CHCO
![]() CHCO
R
CHCO
R
CARBENICILLINA CARFECILLINA
COOH COO
CHCO R
SULBENICILLINA
SO3H
CHCO R CHCO R TICARCILLINA
![]() COO
COO
![]() CARINDACILLINA
S COOH
CARINDACILLINA
S COOH
Figura 3.6 Struttura delle carbossi- e sulfossipenicilline.
CHCO R CHCO R
MEZLOCILLINA PIPERACILLINA
NH
![]() O
O
![]() NHO
NHO![]() O
CON
O
CON
![]() NSO2CH3
CON
NSO2CH3
CON
![]() NCH
NCH
25
N
Figura 3.7 Acilureidopenicilline anti-Pseudomonas.
MECILLINAM PIVMECILLINAM
![]() S
S
![]()
![]() S
S
CH![]() NCH=N
NCH=N
NCH=N CH
3
N CH33 N CH3 O O COOH O COOCH2OCC (CH3)3
CHCO R
NH
![]() O
AZLOCILLINA
O
AZLOCILLINA
![]() NH
OH APALCILLINA N
NH
OH APALCILLINA N
CHCO R
CONN CO
Figura 3.8 Struttura delle amdinopenicilline.
72
A seconda del loro potere di induzione delle
beta-lattamasi si distinguono:
-le penicilline deboli induttrici delle beta-lattamasi:
carbossi- ed ureidopenicilline, temocillina, penicilline
antistafilococciche. -le penicilline potenti induttrici delle beta-lattamasi: penicillina G e V, aminopenicilline. In base al loro spettro d’azione si distinguono: -le penicilline a spettro ristretto: penicilline antistafilococciche: cocchi Gram positivi temocillina, amdinocillina:
enterobatteri -le penicilline a spettro medio: penicillina G e V: cocchi Gram positivi e cocchi Gram negativi, bacilli Gram positivi, anaerobi (ad eccezione dei Bacteroides), Treponema e Leptospira. -le penicilline a largo spettro: aminopenicilline, attive anche nei confronti degli enterobatteri deboli produttori di beta-lattamasi e degli enterococchi. -le penicilline a spettro d’azione molto largo: carbossi- ed ureidopenicilline, attive anche diversamente alle
aminopenicilline, nei confronti di Pseudomonas aeruginosa, Klebsiella, anaerobi (Bacteroides). Uno spettro quasi completo è assicurato dall’associazione di una aminopenicillina con un inibitore delle beta-lattamasi, ad eccezione dello Pseudomonas e degli enterobatteri produttori di cefalosporinasi cromosomiche di classe I.
Composizione chimica
La benzilpenicillina (penicillina G) viene ottenuta per fermentazione dal Penicillium chrysogenum, a partire da un precursore, l’acido para-aminofenilacetico; la penicillina V, invece, da un altro precursore, l’acido fenossiacetico. Il nucleo comune di tutte le penicilline semisintetiche è l’acido 6-aminopenicillanico (6-APA). Attualmente il 6-APA viene ottenuto per azione di una amidasi batterica che stacca la catena laterale della penicil-lina G estrattiva. Il 6-APA di per sé esplica attività antibatterica, benché molto scarsa, può essere considerato come formato da due aminoacidi, la cisteina e la valina, fusi in un doppio anello beta-lattamico-tiazolidinico, quest’ulti-mo portatore di un gruppo carbossilico in posizione 3 con il nucleo beta-lattamico portatore in posizione 6 di un funzione amidica: -NH-CO-R o amidinica: N=C-N-R (amdinocillina). La natura delle sostituzioni nella catena laterale del nucleo beta-lattamico in C6 influenza soprattutto lo spettro e l’intensità dell’attività antibatterica delle penicilline; esempio: -una catena laterale voluminosa in posizione 6-amino (penicilline antistafilococciche) assicura l’attività sugli
stafilococchi produttori di penicillinasi;
-l’attività sugli enterobatteri è aumentata per sostituzione alfa-aminica in C4 (aminopenicilline) e l’attività sullo Pseudomonas è conferita da una sostituzione alfa-carbossi (carbossipenicillina) o alfa-ureido in C6 (ureidopenicilline).
L’esterificazione del gruppo carbossilico in posizione 3 delle aminopenicilline da origine a profarmaci con migliore assorbibilità per via gastroenterica come bacampicillina, pivampicillina, talampicillina che idrolizzati ad opera delle esterasi delle cellule parietali intestinali, liberano l’ampicillina. Contrariamente alle cefalosporine, le penicilline non presentano sostituzioni sul gruppo carbossilico del nucleo tiazolidinico, salvo che per i profarmaci destinati ad assicurare un assorbimento gastroenterico (esteri dell’ampicil-lina e del mecillinam). Un’altra differenza chimica è data dal fatto che il gruppo aminotiazol-metossi-imina, che ha rivoluzionato le cefa-losporine (sostituzione in C7) non si inserisce sul nucleo delle penicilline. Infine, la sostituzione 6-alfa-metossi (corrispondente al gruppo 7-alfa-metossi delle cefamicine e degli oxacefemi; vedi cefalosporine) che assicura la resistenza all’idrolisi da parte delle beta-lattamasi, non si ritrova tra le penicilline eccetto che sulla temocillina. Le penicilline sono degli acidi che formano con i cationi (Na+, K+) dei sali idrosolubili: -sali monosodici: penicillina G, ureidopenicilline -sali potassici: penicillina V, penicillina G -sali disodici: carbossipenicilline -sali poco solubili: penicillina procaina Forme esteririficate che sono utilizzate sia per la somministrazione parenterale (benzatina-penicillina G, benetamina-penicillina G) sia per la somministrazione orale (pro-farmaci): bacampicillina, metampicillina, pivampicillina. In base alla carica elettrica, le penicilline possono essere classificate in: -monoanioniche (-): ureidopenicilline -di-anioniche (- -): carbossipenicilline -zwitterioni (+ -): aminopenicilline e, tra le altre beta-lattamine, imipenem, cefepime. Tutte le penicilline sono idrofile, tuttavia le penicilline a spettro ristretto (penicilline antistafilococciche) e gli esteri dell’ampicillina lo sono in minor misura.
BETA-LATTAMINE
Le modifiche della struttura chimica influenzano molti parametri quali la resistenza all’idrolisi da parte delle betalattamasi, l’attività antibatterica, la farmacocinetica e la tolleranza. Le penicilline estrattive sono ancora dosate in unità biologiche (U.I.), mentre tutte le penicilline semisintetiche sono dosate in mg.
Spettro d’azione e resistenze batteriche
Lo spettro d’azione delle penicilline e delle cefalosporine è sovrapponibile per molte specie batteriche, con qualcheeccezione:-Listeria, sensibile alle penicilline, poco sensibile o resistente alla maggior parte delle cefalosporine;-Klebsiella, resistente alla maggior parte delle penicilline, sensibile alla maggior parte delle cefalosporine.Esiste una resistenza crociata tra le diverse penicilline idrolizzate dalle beta-lattamasi (penicilline estrattive,aminopenicilline, carbossipenicilline, ureidopenicilline), così come esiste una resistenza crociata tra le penicilline ele cefalosporine resistenti all’idrolisi da parte delle beta-lattamasi.
A) Penicilline naturali, estrattive Penicillina G, penicillina V:
Il loro spettro d’azione è relativamente ristretto: cocchi Gram positivi, streptococchi di gruppo A, C, G e pneumococ-chi estremamente sensibili con MIC molto basse dell’ordine dello 0.01 µg/ml. Gli streptococchi B, sempre sensibili, presentano delle MIC un pò più elevate (0.06 µg /ml) e gli enterococchi, moderatamente sensibili, presentano MIC di 2 µg/ml. Tuttavia, l’associazione della penicillina G con un aminoglicoside rappresenta l’associazione classica-mente sinergica, in vitro ed in vivo, per gli enterococchi. I rari stafilococchi non secretori di penicillinasi sono anch’essi molto sensibili (MIC 0.01 µg/ml), ma attualmente il 90% degli stafilococchi in ambiente ospedaliero ed il 60-70% di quelli presenti in altri ambienti sono secretori di penicillinasi e quindi, resistenti alla penicillina G. Sono, inoltre, sensibili: -Cocchi Gram negativi: Neisseria meningitidis (MIC 0.02 µg/ml) e Neisseria gonorrhoeae (MIC 0.7 µg/ml) sono estre-
mamente sensibili, con l’eccezione dei ceppi di gonococco secretori di penicillinasi. Tuttavia, la penicillina V è molto meno attiva su Neisseria. -Bacilli Gram positivi: Listeria, Erysipelothrix, Corynebacterium diphteriae, Streptobacillus moniliformis, B. Anthracis
(Nocardia è resistente). -Bacilli Gram negativi: Pasteurella multocida -Anaerobi Gram positivi: Peptococco e peptostreptococco, Clostridium (con l’eccezione di Cl. difficile), Actinomyces -Anaerobi Gram negativi: Fusobacterium ed alcuni Bacteroides (ma il Bacteroides fragilis è più spesso resistente). -Leptospire e spirochete (Borrelia, Treponema) sono estremamente sensibili: MIC 0.03 µg/ml. Le specie resistenti sono: H. influenzae, Enterobacteri, Pseudomonas-Acinetobacter, Bacteroides fragilis, Clostri-dium difficile, stafilococchi e gonococchi secretori di penicillinasi, Nocardia, Brucella, germi intracellulari privi di parete (Chlamydia, Mycoplasma, Rickettsia, Legionella, Mycobacterium). Lo spettro della penicillina V orale è analogo a quello della penicillina G, tuttavia questa è molto meno attiva sui gonococchi. Le penicilline estrattive sono potenti induttori di beta-lattamasi.
B) Penicilline antistafilococciche
Le penicilline antistafilococciche hanno uno spettro antibatterico ristretto, limitato ai cocchi Gram positivi: stafilococ-chi secretori o non secretori di penicillinasi (MIC 0.2 µg/ml), ad eccezione degli stafilococchi meticillino-resistenti,coagulasi positivi (S. aureus) o coagulasi negativi (S. epidermidis, S. haemoliticus) e degli enterococchi. Si tratta, perquesti germi, dell’acquisizione di un nuovo gene cromosomico, che codifica per un tipo nuovo di PBP (PBP 2a), che hauna affinità molto bassa per le penicilline antistafilococciche (resistenza eterogena). Tuttavia, per gli stafilococchi nonsecretori di penicillinasi, la penicillina G è da preferire.Gli streptococchi e pneumococchi, gli anaerobi sensibili alla penicillina G, la Neisseria ed i Clostridi, sono egualmentesensibili, ma la loro MIC è più alta rispetto a quella per le penicilline estrattive, che sono quindi da preferire perquesti germi.La resistenza attuale degli stafilococchi alle penicilline antistafilococciche è la seguente:-Staphylococcus aureus: 10-30% e più, a seconda dell’ospedale-Staph. epidermidis: 20-70%-Staph. haemolyticus: 60-80%Per i cocchi Gram negativi (Neisseria), la loro azione è insufficiente a giustificarne un uso clinico.I bacilli Gram negativi sono resistenti (resistenza naturale). Il B. fragilis è ugualmente resistente. I germi intracellu-lari: Legionella, Chlamydia, Mycoplasma, Rickettsia, Mycobacterium sono anch’essi resistenti.Per mettere in evidenza gli stafilococchi meti-R (ceppo eterogeno), bisogna utilizzare un mezzo ipertonico conte-nente il 5% di cloruro di sodio o incubare la coltura a 30° C.Per i ceppi meti-R si ha resistenza crociata tra cefalosporine ed altre beta-lattamine con contemporanea resistenzaagli aminosidi ed ai macrolidi (Tabella 3.6).
C) Le aminopenicilline
Hanno uno spettro d’azione più ampio della penicillina G, includendo anche germi che rientrano nello spettro d’azione della penicillina G: cocchi Gram positivi (streptococchi, pneumococchi, ma anche gli enterococchi) e coc-chi Gram negativi (Neisseria), bacilli Gram positivi (Listeria), anaerobi Gram positivi (Clostridium) e Gram negativi (Fusobacterium, Pasteurella, Leptospira e spirochete, H. influenzae non produttore di beta-lattamasi (MIC 0.25 µg/ ml), enterobatteri scarsi produttori di beta-lattamasi: E. coli, Salmonella, Shigella (resistenza attuale in aumento per questi ultimi, soprattutto per S. sonnei), Proteus mirabilis; ma anche Bordetella, Eikenella, Brucella, Pasteurella, Vibrio cholerae, Leptospira, Treponema, Gardnerella vaginalis, alcuni anaerobi: Clostridium, Fusobacterium. Le specie batteriche più sensibili sono la Neisseria (MIC 0.06 µg/ml) e gli streptococchi-pneumococchi (MIC 0.03 µg/ml). Gli enterococchi e Listeria sono più sensibili alla penicillina G. I bacilli Gram positivi sensibili sono: Listeria, Corynebacterium, Erysipelotrix, B. anthracis, ma non la Nocardia. Tuttavia, la resistenza attuale è in aumento: 10-20% per H. influenzae, soprattutto per i ceppi capsulati, responsabili delle manifestazioni invasive, 30% per E. coli e Shigella, 60-80% per Moraxella catarrhalis, 90% per gli stafilococchi meti-R. Le specie resistenti riguardano enterobatteri grandi produttori di beta-lattamasi: Klebsiella, Enterobacter, Serratia, Proteus rettgeri , Providencia, Citrobacter, così come Pseudomonas ed Acinetobacter, Brucella, Yersinia, Campylo-bacter (jejuni, foetus), Bacteroides fragilis, Clostridium difficile, stafilococco, gonococco e H. influenzae produttore di penicillinasi, E. faecium, Nocardia, Vibrio cholerae (> 80% di resistenza) ed i germi intracellulari privi di parete (Mycoplasma, Chlamydia, Rickettsia, Legionella). Esiste qualche differenza nello spettro antibatterico dell’ampicillina e dell’amoxicillina: l’ampicillina è più attiva sulla Shigella, l’amoxicillina è più attiva sulle salmonelle e sugli pneumococchi poco sensibili alla penicillina. Le aminopenicilline sono potenti induttori delle beta-lattamasi e sono caratterizzate da un debole effetto inoculo.
Le aminopenicilline associate ad inibitori delle beta-lattamasi
(acido clavulanico, sulbactam, tazobactam) hanno uno spettro antibatterico ancora più largo che include Klebsiella, Proteus vulgaris, Campylobacter, Bacteroides fragilis, stafilococchi secretori di penicillinasi, gonococchi, Haemophi-lus e Branhamella secretori di beta-lattamasi. Restano resistenti: gli enterobatteri ed altri bacilli Gram negativi, microorganismi grandi produttori potenziali di cefalosporinasi di classe I non inibite da queste molecole: Enterobacter, Citrobacter, Serratia, Proteus rettgeri e morganii, Providencia, Yersinia, Pseudomonas, Acinetobacter, così come lo stafilococco meticillino-resistente ed i germi a localizzazione intracellulare.
L’amdinocillina ed il suo pro-farmaco a somministrazione orale, il pivmecillinam, hanno uno spettro ristretto, limitato a certi enterobatteri: E. coli, Proteus mirabilis, Klebsiella, Salmonella, Shigella, Citrobacter, Enterobacter e Yersinia (Kleb-siella, Citrobacter, Enterobacter, Yersinia sono resistenti alle aminopenicilline). L’amdinocillina presenta una buona stabilità alle beta-lattamasi batteriche, superiore a quella delle aminopenicilline, anche per i ceppi grandi produt-tori di cefalosporinasi. Sono resistenti: Proteus indolo positivo, Providencia, Serratia, Pseudomonas, Acinetobacter, Campylobacter, Hae-mophilus, Neisserie e cocchi ed i bacilli Gram positivi e gli anaerobi. I ceppi grandi produttori di penicillinasi appar-tenenti alle specie Klebsiella, Enterobacter, Citrobacter, Serratia, sono parimenti resistenti. L’amdinocillina esplica un’azione sinergica con altre beta-lattamine attraverso una differente fissazione sulle PBP (sulla PBP 2 l’amdinocillina, sulle PBP 1 e 3 la grande maggioranza delle altre beta-lattamine, sulla PBP 3 l’aztreonam).
Le carbossipenicilline
hanno uno spettro largo che, rispetto a quello delle aminopenicilline, include in più: cocchi Gram positivi (adeccezione dell’enterococco, poco sensibile) e cocchi Gram negativi, bacilli Gram positivi, alcuni enterobatteri, H.influenzae, Bordetella, Brucella, Pasteurella, Vibrio cholerae, alcuni anaerobi:-Pseudomonas aeruginosa, P. maltophila e Acinetobacter che presentano una MIC di 32-64 µg/ml per la carbenicillina
e di 16-32 µgml per la ticarcillina
-enterobatteri produttori di cefalosporinasi, resistenti alle aminopenicilline (le carbossipenicilline sono inibitrici e resistenti all’idrolisi da parte delle cefalosporinasi): Proteus indolo positivo, Providencia, Citrobacter, Enterobacter, Serratia, Bacteroides fragilis.
-anaerobi Gram positivi e Gram negativi con attività, tuttavia, inferiore a quella delle ureidopenicilline su Bacteroides.-coccobacilli Gram negativi con non secretori di beta-lattamasi come Haemophilus e Neisseria.In rapporto alle aminopenicilline ed alle ureidopenicilline, la loro attività è nettamente inferiore su Enterococcusfaecalis ed inferiore sugli enterobatteri non produttori di beta-lattamasi. Tuttavia, rispetto alle ureidopenicilline, laloro azione è più rapidamente battericida e l’effetto inoculo è meno pronunciato.Allo stato attuale, la frequenza dei ceppi resistenti alle carbossipenicilline è alta per i bacilli Gram negativi, grandiproduttori di cefalosporinasi di classe I e di beta-lattamasi a spettro allargato: Providencia stuartii (75%),
BETA-LATTAMINE
Acinetobacter, Serratia e Citrobacter (50%), Proteus vulgaris (40%), Pseudomonas aeruginosa (10-50%), Entero-bacter (30%), Bacteroides (15-30%), E. coli e Proteus mirabilis (15-20%).Germi resistenti: stafilococchi secretori di penicillinasi: Neisseria, H. influenzae e Branhamella catharralis; grandiproduttori di penicillinasi: Klebsiella, Yersinia, Nocardia; germi intracellulari: Chlamydia, Mycoplasma, Rickettsia,Legionella, Brucella.Associazioni sinergiche sugli anaerobi (Bacteroides) si possono attuare con gli inibitori delle beta-lattamasi.
Le carbossipenicilline associate ad un inibitore delle beta-lattamasi(esempio, ticarcillina + acido clavulanico), allargano ancora di più spettro d’azione include anche germi produttoridi beta-lattamasi a largo spettro e resistenti alle sole carbossipenicillinasi: stafilococchi (ad eccezione dello stafilo-cocco meticillino-resistente), Neisseria, H. influenzae, Branhamella catharralis, Klebsiella, Yersinia, Pseudomonas,Xanthomonas maltophila, anaerobi (Bacteroides).
Le ureidopenicilline
hanno uno spettro antibatterico largo, molto vicino a quelle delle carbossipenicilline, con qualche particolarità: -attività superiore ripetto alle aminopenicilline sui cocchi Gram positivi come streptococchi, pneumococchi e
soprattutto sugli enterococchi (E. faecalis e E. faecium); su questi ultimi, le carbossipenicilline sono più attive; -attività leggermente superiore sui bacilli Gram positivi: Listeria, Erysipelotrix -attività leggermente superiore sugli Pseudomonas, anche resistenti alle carbossipenicilline, ma non produttori di
penicillinasi costitutive di classe III e V
-attività su Klebsiella (che è resistente alle carbossipenicilline), soprattutto con la mezlocillina, con l’eccezione (recente) di Klebsiella grande produttore di beta-lattamasi plasmidiche a largo spettro (SHV-2, CTX, etc) resisten-te anche alle cefalosporine di terza generazione
-una buona attività, leggermente superiore a quella delle carbossipenicilline, sugli anaerobi Gram positivi (Clostri-
dium, peptococchi, peptostreptococchi) e Gram negativi: Bacteroides secretori di beta-lattamasi -buona attività sui coccobacilli Gram negativi: Haemophilus. Tuttavia, le carbossipenicilline sono più resistenti all’idrolisi operata dalle beta-lattamasi cromosomiche di classe I dello Pseudomonas. Tra le ureidopenicilline, vi è parimenti qualche particolarità riguardo il loro spettro batterico: -nei confronti di Pseudomonas le più attive in vitro sono, in ordine decrescente, la piperacillina, l’azlocillina e la
mezlocillina; quest’ultima possiede in vitro un’attività comparabile alla ticarcillina
-sugli enterobatteri l’attività dell’azlocillina è inferiore a quella delle altre ureidopenicilline. Sugli enterobatteri produttori di cefalosporinasi (Enterobacter, Citrobacter, Serratia, Proteus indolo positivo), la loro attività è equi-valente a quella delle carbossipenicilline. Tuttavia, le ureidopenicilline, come le carbossipenicilline, sono inattive sui mutanti derepressi stabili, grandi produttori di cefalosporinasi
-su Acinetobacter la loro attività è modesta, come quella delle carbossipenicilline -sulle Enterobacteriaceae scarsi produttori di beta-lattamasi (E. coli, Salmonella, Shigella, Proteus mirabilis), l’attività delle ureidopenicilline è equivalente a quella delle aminopenicilline. -sui cocchi Gram positivi ed i cocchi e coccobacilli Gram negativi (Neisseria ed Haemophilus) le ureidopenicilline
presentano un’attività equivalente a quella delle aminopenicilline, così come sugli enterococchi. Germi resistenti sono: stafilococchi, Haemophilus e Neisseria produttori di penicillinasi, germi intracellulari (Chlamydia, Mycoplasma, Rickettsia, Legionella). La Temocillina ha uno spettro batterico ristretto limitato ai batteri Gram negativi: enterobatteri, Brucella, Pasteurella, Haemophilus, Neisseria. Essa si caratterizza per una grande stabilità all’azione idrolitica delle beta-lattamasi di classe I, III, IV e V. Contrariamente alla ticarcillina, da cui deriva, essa è inattiva su Pseudomonas (ad eccezione di Pseudomonas cepacia che è sensibile), su Acinetobacter, Campylobacter, così come sui cocchi Gram positivi e gli anaerobi Gram positivi e Gram negativi, mentre è più attiva su Serratia.
Farmacocinetica
La farmacocinetica delle penicilline è variabile; essa può essere (Tabella 3.7): -lineare, cioè le concentrazioni sieriche, l’AUC e le clearance (renale e totale) aumentano proporzionalmente alle dosi somministrate; esempi sono la penicillina G e le carbossipenicilline;
-dose-dipendente positiva, vale a dire che l’aumento delle dosi comporta un aumento non lineare delle concentra-zioni sieriche e dell’AUC, un allungamento della emivita, una diminuzione delle clearance e del volume di distri-buzione; un esempio è dato dalle ureidopenicilline;
-dose-dipendente negativa, vale a dire che l’aumento delle dosi provoca una diminuzione della emivita, un au-mento della frazione libera non legata alle proteine, una eliminazione più rapida; esempi sono date dalle aminopenicilline e dalle penicilline antistafilococciche.
I parametri farmacocinetici più variabili riguardano: l’assorbimento intestinale, le concentrazioni sieriche, l’emivita plasmatica, il legame con le proteine plasmatiche, l’eliminazione biliare ed urinaria. a) Assorbimento gastrointestinale
La penicillina G, le carbossipenicilline e le ureidopenicilline non sono assorbite per via orale; esse vanno quindi somministrate esclusivamente per via parenterale. Da notare che, contrariamente alle cefalosporine, l’esterificazione in posizione C3 delle carbossipenicilline, allo scopo di ottenere dei prodotti per la somministrazione orale (carcillina, carindacillina) non si è imposta nella pratica. Solo l’esterificazione dell’amdinocillina a quel livello è attualmente utilizzata (pivmecillinam). L’assorbimento gastroenterico della penicillina V e delle penicilline orali antistafilococciche è di media entità (circa il 50%), esso è migliore a digiuno mentre è parzialmente ostacolato dalla presenza degli alimenti. L’assorbimento gastroenterico dell’ampicillina e dell’etacillina è mediocre (circa il 30%) e soggetto a grandi variazioni individuali. È nettamente migliore (circa l’80%) in associazione col sulbactam. Al contrario, l’assorbi-mento digestivo dell’amoxicillina e degli esteri pro-farmaci dell’ampicillina (bacampicillina, lenampicillina, pivampicillina, talampicillina), così come quello del pivmecillinam, è quasi completo (>90%) ed indipendente (non influenzato) dalla presenza degli alimenti.
b) Le concentrazioni sieriche sono in funzione della dose, della via di somministrazione e delle formulazioni farma-ceutiche. Esempio: per la penicillina G sodica o potassica i picchi sierici più alti (necessari nel trattamento delle meningiti, delle endocarditi) sono ottenuti con perfusioni intermittenti e discontinue (500-700 UI dopo 10 milioni di UI). La procaina penicillina G raggiunge picchi sierici più bassi: 5-15 UI dopo 1000 UI per via im; la benzatina penicillina G dà picchi sierici bassi (1.2 UI dopo 2.000 UI per via im) ma molto prolungati, con concentrazioni sieriche residue di 0.12 UI al 14° giorno). Le concentrazioni sieriche della maggior parte delle penicilline possono ancora essere aumentate e prolungate attraverso il blocco della loro escrezione tubulare col probenecid. Gli esteri dell’ampicillina liberano per idrolisi l’ampicillina che si ritrova nel plasma. Al contrario, l’amoxicillina circola nel plasma nella sua forma originaria. La metampicillina somministrata per via parenterale viene idrolizzata più lentamente se somministrata per via orale e questo si rispecchia nel ritrovamento nel sangue di metampicillina intatta e di ampicillina. Per via orale la metampicillina ha una biodisponibilità di circa il 60% e viene idrolizzata totalmente e rapidamen-te in ampicillina. La concentrazione nella linfa è elevata soprattutto con le aminopenicilline e la temocillina. L’oxacillina (500 mg) raggiunge picchi di 4 µg/ml (via orale), di 11 µg/ml (via im) e di 40 µg/ml (via ev); per la cloxacillina i tassi sono di 9.15 e 100 µg/ml rispettivamente per via orale e per via parenterale.
c) L’emivita plasmatica della grande maggioranza delle penicilline è breve (≤1.5 ore), ad eccezione della temocillina (5 ore) e delle penicilline G retard: 6 ore per penicillina procaina, molto più lunga per la penicillina benzatina G. Per le penicilline la cui farmacocinetica è dose-dipendente, ad esempio le ureidopenicilline, l’emivita è anch’essa dose dipendente. In caso di insufficienza renale severa, l’emivita si allunga considerevolmente, soprattutto per la penicillina G (10 ore), le aminopenicilline (8 ore), le carbossipenicilline (15 ore), la temocillina (17 ore).
d) Il legame alle proteine plasmatiche è molto variabile da una penicillina ad un altra e può essere distinto nel seguente modo: -penicilline scarsamente legate alle proteine plasmatiche (< 35%): aminopenicilline, acido clavulanico, tazobactam,
pivmecillinam, ureidopenicilline (ad eccezione dell’apalcillina) -penicilline mediamente legate alle proteine plasmatiche (40-65%): penicilline G e V, meticillina, carbossipenicilline -penicilline fortemente legate alle proteine plasmatiche (> 80%): isossazolilpenicilline, nafcillina, apalcillina,
temocillina.
e) Il volume di distribuzione è relativamente basso (0.10-0.30 l/Kg) e limitato agli spazi extracellulari. La diffusione nel liquor è relativamente bassa con meningi indenni, migliore in caso di infiammazione meningea, soprattutto con le aminopenicilline, le ureidopenicilline e la nafcillina. L’associazione con probenecid può aumentare le con-centrazioni nel liquor. Le penicilline antistafilococciche raggiungono concentrazioni insufficienti nel liquor, tenuto conto della loro MIC nei confronti degli stafilococchi; hanno buona diffusione placentare, circa 50% delle concentrazioni sieriche, e nel liquido amniotico. Le concentrazioni biliari il più delle volte sono in rapporto alle concentrazioni sieriche, soprattutto con le aminopenicilline (ed in particolare con la metampicillina), le ureidopenicilline e le penicilline antistafilococciche (soprattutto con la nafcillina). Da notare che l’eliminazione biliare dell’amoxicillina è inferiore a quella dell’ampicillina. Si ha diffusione nel latte materno e passaggio placentare.
BETA-LATTAMINE
f) Biotrasformazione metabolica. La quasi totalità delle penicilline è scarsamente metabolizzata (< 25%); vengono eliminate in grande maggioranza sottoforma attiva. Solo le penicilline antistafilococciche: oxacillina, nafcillina, come anche cilastatina, acido clavulanico ed i penemi, subiscono una biotrasformazione importante pari a circa il 50%.
g) L’eliminazione renale è la via predominante di escrezione, ad eccezione della nafcilina e dell’apalcillina che sono eliminate principalmente (80%) per via epato-biliare. L’eliminazione renale delle penicilline sottoforma attiva si verifica per filtrazione glomerulare (20%) e, soprattutto, per secrezione tubulare (80%) che assicura concentra-zioni urinarie elevate; tale secrezione può essere bloccata dal probenecid, con aumento dei tassi sierici, dell’emi-vita e con diminuzione dei tassi urinari (penicillina G, aminopenicilline, ureidopenicilline, penicilline antistafilococciche). Per le ureidopenicilline, l’eliminazione renale è dose-dipendente (processo di saturazione renale, di secrezione tubulare dopo aumento delle dosi). Per le carbossipenicilline e la temocillina, la filtrazione glomerulare è la via di eliminazione renale predominante, a scapito della secrezione tubulare. Certe penicilline, come l’apalcillina, subiscono in più un importante riassorbi-mento tubulare. La clearance renale delle carbossipenicilline è nettamente più bassa di quella delle aminopenicilline (120 vs 250-300) e questo spiega i tassi sierici molto elevati delle carbossipenicilline. Le concentrazioni urinarie sono elevate soprattutto con le aminopenicilline, le carbossipenicilline e le ureidopenicilline. La presenza di una insufficienza renale impone una riduzione od un distanziamento delle dosi, ad eccezione delle penicilline, eliminate principalmente per via epato-biliare. La piperacillina possiede anche un effetto tipo “probenecid” in quanto inibisce il trasporto e l’accumulo nelle cellule tubulari renali di alcuni antibiotici nefrotossici (cefaloridina, aminoglicosidi). Le penicilline sono emodializzabili.
Tossicità ed effetti indesiderati
Le penicilline hanno una tossicità acuta estremamente scarsa. Tuttavia, il loro uso molto diffuso ha provocato incidenti, a volte anche gravi o mortali, di natura allergica (shock anafilattico).
A. Inconvenienti legati ad un meccanismo tossico
a) Intolleranza locale. Nel punto di iniezione im le penicilline possono provocare dolore, infiltrazione e comparsa di noduli, eccezionalmente delle nevriti (sciatica), soprattutto con soluzioni troppo concentrate, ipertoniche (> 200000 UI/ml) e con le penicilline G retard (controindicate nei lattanti). Per infusioni ev prolungate e ripetute possono comparire trombosi venose (soprattutto con la penicillina G potassica, più irritante per la parete venosa). In caso di iniezione intraarteriosa accidentale, le penicilline retard e semisintetiche possono provocare necrosi. Per via intrarachidea o per applicazione diretta diretta al tessuto nervoso cerebrale (neurochirurgia), le penicilline possono provocare convulsioni, meningiti (aracnoiditi), emorragie meningee, mieliti. Per prevenire questi eventi non bisogna superare una concentrazione di 8 UI/ml nel liquor, non usare soluzioni più concentrate di 1000 UI/ml e non superare la quantità di 15000-20000 UI di penicillina G pro-dose, (preferibilmente unica). Mai iniettare per via intrarachidea la procaina penicillina e le altre penicilline retard. Per via orale, una intolleranza gastrioenterica dose-dipendente può aversi soprattutto con le aminopenicilline ed in particolare con amossicillina-clavulanato.
b) Neurotossicità. Alcune penicilline, soprattutto la penicillina G, le carbossipenicilline, l’imipenem, a dosi molto elevate, in perfusione iv e/o in presenza di insufficienza renale e/o di precedenti neuropsichici, possono provocare convulsioni, mioclonie e segni di encefalite. Per prevenirli, controllare i soggetti a rischio, le concentrazioni delle penicilline nei liquidi (< 10 UI/ml), ridurre la posologia giornaliera ed utilizzare di preferenza un’aminopenicillina. La penicillina G procaina per via im può provocare una sindrome di Hoignè, per danno vascolare ed embolia dovuta alla penetrazione dei cristalli di penicillina-procaina con conseguente breve ischemia cerebrale che si manifesta con malessere, vertigini, lipotimia, ma che si risolve rapidamente per la rapida idrolisi della procaina.
c) Turbe elettrolitiche. I sali monosodici, ma soprattutto disodici, delle penicilline utilizzate a dosi elevate (penicil-lina G sodica o potassica, carbossipenicilline), possono provocare: ipernatriemia, ipokaliemia con alcalosi meta-bolica, iperkalemia, soprattutto in presenza di un’insufficienza renale o cardiaca.
d) Turbe della coagulazione (diatesi emorragiche) possono aversi per:
-disfunzione piastrinica dose e tempo dipendente: inibizione dell’aggregazione e dell’adesività piastrinica, pro-vocata da dosi molto alte di penicillina G o di carbossipenicillina, soprattutto nei pazienti anziani, in presenza di una insufficienza renale o per concomitante assunzione di ASA. Le ureidopenicilline e le cefalosporine espon-gono molto meno al rischio di coagulopatie.
-ipoprotrombinemia indotta: carbossipenicilline. -Fattori predisponenti: carenza di vitamina K (malnutrizione, alimentazione parenterale), penicilline con un gruppo carbossilico in posizione 10. e) Ittero nucleare può osservarsi eccezionalmente nei lattanti e nei neonati con l’uso di penicilline ad alto legame con le proteine plasmatiche (isossazolilpenicilline, nafcillina, apalcillina, temocillina).
f) Epatotossicità si documenta più spesso attraverso una semplice elevazione, reversibile, delle transaminasi e della fosfatasi alcalina. Molto più raramente una colestasi può essere indotta dalle penicilline antistafilococciche e dalle carbossipenicilline.
g) Carenza di carnitina può essere determinata dagli esteri pivalici delle penicilline e delle cefalosporine orali (pivmecillinam, pivampicillina, cefetamet-pivoxil) (soprattutto nei bambini e nell’uso prolungato) a seguito di un aumento dell’escrezione urinaria della carnitina esterificata ad acido pivalico. Questa carenza può manifestarsi con astenia generale e muscolare, ipoglicemia, sintomi cardiaci.
B. Reazioni allergiche - immunologiche
Le reazioni di tipo I, dovute ad IgE sensibilizzanti i basofili ed i mastociti, sono rare ma ad evoluzione severa: orticaria precoce, edema di Quincke, crisi di asma, eccezionalmente shock anafilattico. Le reazioni di tipo II, citolitiche, provocano delle leucopenie-neutropenie, trombocitopenie e anemie emolitiche reversibili. Le leucopenie-neutropenie indotte dalle penicilline sono dose-dipendenti dopo trattamento prolungato di più di 10 giorni; esse sono favorite da soluzioni preparate diverse ore prima dell’utilizzo: penicillina G, penicilline antistafilococciche, carbossipenicilline. Il loro meccanismo d’azione è probabilmente misto, immunologico e mielotossico. Le anemie emolitiche da IgG e IgM compaiono soprattutto per dosi elevate e per trattamenti prolungati con peni-cillina G, favorite dalla presenza di insufficienza renale. L’emolisi è più spesso extravascolare, senza compartecipa-zione del complemento, più raramente è intravascolare con attivazione del complemento. Le trombocitopenie possono essere latenti e causare porpore con sindrome emorragica. Casi di trombocitosi latenti sono state segnalate con l’amdinocillina e l’imipenem. Una eosinofilia latente viene spesso osservata nel corso del trattamento. Le reazioni di tipo III, dovute alla formazione di immunocomplessi circolanti, depositati sulla parete dei vasi (IgG e IgM) sono responsabili di vasculiti, glomeruliti, nefriti interstiziali (meticillina), malattie da siero con adenopatie, artralgie e reazioni febbrili, lupus eritematoso disseminato iatrogeno. Il determinante antigenico maggiore delle penicilline (95%) è l’acido benzilpenicillinoico, formato per idrolisi del nucleo beta-lattamico ad opera delle penicillinasi; esso è responsabile delle reazioni allergiche accellerate. Il determinante antigenico minore (5%) è costituito dall’acido benzilpenicillamico e benzilpenemaldil, per trasforma-zione spontanea (polimerizzazione) della penicillina in soluzione in un isomero reattivo responsabile delle reazioni immediate e di alcune reazioni accelerate. Per la somministrazione endovenosa bisogna dunque utilizzare dei soluti preparati estemporaneamente aventi un pH neutro (soluzione fisiologica tamponata). Evitare le infusioni continue di lunga durata che favoriscono la formazione di polimeri di penicillina o di derivati esterificati con polioli (glucosio, fruttosio), in pH alcalino (Figura 3.9). Le reazioni allergiche più frequenti alle penicilline sono le eruzioni cutanee di tipo maculo-papulare od orticarioidi. Esse sono più frequenti con le penicilline che con le cefalosporine: il nucleo cefalosporinoil è più instabile e si idrolizza più facilmente del nucleo penicilloil. Le aminopenicilline provocano più spesso delle altre penicilline eruzioni cutanee maculo-papulari, non orticaroidi, più tardive, reversibili, anche se si prosegue nel trattamento. Il loro meccanismo è differente e mal conosciuto. La loro frequenza è particolarmente alta nel corso della mononucleosi infettiva, delle infezioni da citomegalovirus, di leucemia linfoide cronica, di iperuricemia trattata con allopurinolo. Nefriti interstiziali e cistiti emorragiche su base immunologica sono state segnalate soprattutto con la meticillina. Le reazioni immediate (shock anafilattico, etc) si osservano entro 30 minuti dalla somministrazione nei soggetti già sensibilizzati con precedenti somministrazioni di penicilline o nei soggetti che presentano epidermofiti genetica-mente correlati con le penicilline o che hanno ricevuto precedenti trattamenti con penicillamina. Le penicilline orali generalmente espongono di meno a rischio di reazioni immediate rispetto alle penicilline sommi-nistrate per via parenterale. La polvere orale di penicillina V può esporre ad una intolleranza alle proteine del latte vaccino. La prevenzione dello shock anafilattico richiede in primo luogo un’attenta anamnesi riguardo eventuali precedenti somministrazioni di beta-lattamine e alla loro tolleranza. Il dosaggio delle IgE specifiche e, se negativo, l’assunzione di una dose per os di penicillina, permette di escludere le false allergie alle penicilline. Si può anche utilizzare, a scopo orientativo, una intradermoreazione con penicilloil-polilisina che presenta, tuttavia,
BETA-LATTAMINE
PENICILLINA BENZIL PENICILLOIL (BPO) (DETERMINANTE MAGGIORE)
O O
![]()
![]() S
S
![]() S
S
![]() HCH
HCH
![]() CH
CH
3
![]() 3
3
CHCNHCH-CH C CHCNHCCH C
2 2
CH
![]() CH
CH
3 3
![]() C
N CHCOOH
C
N CHCOOH
![]() O
C N CHCOOH O
O
C N CHCOOH O
Proteina
PENICILLINATO (DETERMINANTE MINORE) S-PENAMALDIL
Proteina
![]() Proteina
Proteina
H S![]() CH3
CH3
![]() OH
S
OH
S![]()
![]() CH3
N CCH
CH3
N CCH
C
![]() CH2C
N CH CH CCH
CH2C
N CH CH CCH
3
CH
3
C COOHCH2C
![]()
![]() CHN
COOH NH C COOH
CHN
COOH NH C COOH
HHO
O
Figura 3.9 Composti allergenici delle penicilline.
una certa percentuale di falsa positività e di falsa negatività. La lettura del test va fatta dopo 20 minuti, a 24 ore e a 48
ore. Il trattamento dello shock anafilattico da penicilline è un trattamento di urgenza: adrenalina all’1% im e/o ev,
idrocortisone emisuccinato in infusione endovenosa, antistaminici iniettabili, intubazione tracheale, ossigenoterapia.
Quando l’indicazione all’uso di una penicillina è obbligatoria in un soggetto allergico alle penicilline si può ricorrere:
- alla sostituzione della penicillina con un monobattamico; se il germe isolato lo consente
-ad un trattamento desensibilizzante sotto protezione cortisonica, cominciando con dosi molto basse (1 UI) da somministrare ogni mezz’ora, poi progressivamente somministrando dosi sempre più alte per via prima intrader-mica, poi sottocutanea ed infine im, praticando delle iniezioni alla radice di un arto e non nella natica affinché, in caso di shock, si possa applicare subito un laccio emostatico. Questa protezione dura solamente fino a quando il trattamento è continuato; in caso di interruzione di quest’ultimo, alla ripresa bisogna ripetere la procedura in tutte le sue fasi.
C. Le reazioni di biotropismo (microbiologiche)
-Le reazioni di Herheimer si osservano soprattutto nel corso del trattamento iniziale della sifilide; esse consistono nell’accentuazione delle eruzioni esistenti, delle adenopatie, in accessi febbrili e emorragie vascolari. Nel corso di un trattamento della gonorrea con penicillina ogni rialzo febbrile deve attirare l’attenzione ed imporre un ulterio-re controllo sierologico per la ricerca di una eventuale sifilide associata. La prevenzione delle reazioni di Herheimer richiede dosi iniziali ridotte, aumentate progressivamente, sotto protezione cortisonica.
-Le sovrainfezioni, per effetti di selezione delle penicilline sulla flora saprofita normale con colonizzazione da parte di germi resistenti, commensali od intervenuti dall’esterno, che compaiono nel corso del trattamento con le penicilline a largo spettro sono sostenute più frequentemente dai seguenti germi:
- Pseudomonas, Klebsiella, Mycoplasma,
Chlamydia, Candida, con le aminopenicilline;
- Enterococchi, Providencia (con le
carbossipenicilline utilizzate da sole)
- Stafilococchi meti-R, Pseudomonas,
Candida (con imipenem)
- Clostridium difficile (coliti
acute pseudomembranose), soprattutto con le penicilline a
largo spettro, a preva-lente eliminazione biliare:
aminopenicilline, apalcilline
-Le reazioni legate alla lisi batterica (fenomeno di Reilly) possono osservarsi nel corso del trattamento delle setticemie da bacilli Gram negativi con dosi iniziali di attacco e sono dovute all’aumento dell’endotossinemia.
Indicazioni cliniche
Penicillina G e Penicillina V
-Trattamento delle angine streptococciche, soprattutto nei soggetti a rischio e dell’angina di Vincent (associazio-ne fuso-spirillare), in associazione con un nitroimidazolico. Il trattamento precoce con penicillina permette una riduzione del periodo di evoluzione e l’eradicazione degli streptococchi dal faringe, quindi una diminuzione netta della frequenza della malattia reumatica tra i ragazzi. Si può utilizzare la penicillina G, la penicillina procaina, la penicillina benzatina od una penicillina orale se la disfagia ne permette l’assunzione per os, in caso di angina acuta primitiva od episodica non recidivante (trattamento per 10 giorni).
-Trattamento delle polmoniti batteriche pneumococciche: penicillina G. In caso di pneumococco di sensibilità diminuita alla penicillina G, ricorrere ad una cefalosporina di terza generazione (ceftriaxone).
-Ascesso polmonare da pneumococco o da germi anaerobi: in questo caso associare la penicillina G ad un nitroimidazolico.
-Trattamento delle meningiti pneumococciche e meningococciche dell’adulto: penicillina G in infusione endove-nosa per 10-15 giorni (malgrado la scarsa diffusione nel liquor).
-Ascesso cerebrale conseguente a patologie di interesse ORL (streptococchi anaerobi): penicillina G + nitroimidazolico.
-Endocarditi da Streptococcus viridans o da enterococco: penicillina G, da sola (S. viridans) o associata ad un aminoside (enterococco) per 15-30 giorni per lo S. viridans (a seconda se vi sono o meno delle vegetazioni endocardiche all’ecocardiogramma) o per 40 giorni in caso sia coinvolto l’enterococco.
- Trattamento dell’actinomicosi: penicillina G (5-10 milioni UI/die), associata al metronidazolo.
-Trattamento della sifilide primaria o secondaria: penicillina benzatina in unica somministrazione im, oppure penicillina G benzatina semiretard: procaina penicillina, benetamina penicillina G, per 10-15 giorni.
- Trattamento delle leptospirosi e della borreliosi.
-Trattamento di infezioni gonococciche: penicillina G procaina im + probenecid (ma in questa indicazione essa è attualmente in competizione con altre beta-lattamine ed altri antibiotici). Non utilizzare la penicillina V in questa condizione.
- Trattamento delle pasteurellosi.
- Trattamento dell’erisipela: penicillina G, secondo la localizzazione, o penicillina V.
- Trattamento dell’erisipeloide di Rosenbach: penicillina G.
-Trattamento della gangrena gassosa (Cl. perfrigens) e della fascite necrotizzante da anaerobi (Peptococco, Fusobacterium, peptostreptococchi): penicillina G a forti dosi + escissione chirurgica dei tessuti necrotici.
- Trattamento adiuvante della difterite e del tetano (+ sieroterapia antitossica).
- Profilassi delle recidive del reumatismo articolare acuto: penicillina V o penicillina G benzatina:.
-Profilassi dell’endocardite nel corso di cardiopatia a rischio, prima di sottoporsi a cure dentarie, broncoscopia, colonscopia, cateterismi urinari: penicillina V, penicillina G .
-Profilassi delle infezioni pneumococciche nei soggetti asplenici e drepanocitici: penicillinoterapia a vita più vaccino antipneumococcico.
Penicillina G retard (penicillina G benzatina)
Trattamento delle treponematosi, prevenzione delle recidive del reumatismo articolare acuto.
Aminopenicilline
Le loro indicazioni si sono ridotte come conseguenza dello sviluppo di resistenze batteriche, in continuo aumento
soprattutto per quanto riguarda gli enterobatteri, Haemophilus, Branhamella catharralis, Neisseria, secretori di
beta-lattamasi. Per tutti questi germi si preferisce attualmente l’associazione di un’aminopenicillina con un’inibito
re delle beta-lattamasi (acido clavulanico).
Le indicazioni attuali riguardano:
-infezioni delle basse vie urinarie: per una prima infezione non ospedaliera si può utilizzare un’aminopenicillina da sola anche quando si tratta di un enterococco.
-trattamento delle meningiti purulente perinatali e del bambino: Haemophilus non secretore di beta-lattamasi, Streptococco B, Listeria (per questi ultimi due si associa un aminoglicoside) o meningiti dell’adulto (meningococ-co, pneumococco): aminopenicillina in infusione ev.
-trattamento delle endocarditi da Streptococcus viridans o da enterococco, in associazione con un aminoglicoside
o un glicopeptide. -trattamento di attacco delle setticemie da bacilli Gram negativi, in associazione con un aminoglicoside. -trattamento delle infezioni polmonari ad eccezione di quelle sostenute da Micoplasma, Clamydia, Legionella. -trattamento delle infezioni ORL e bronchiali: sinusiti, angine, otiti (preferibilmente amossicillina-clavulanato,
essendo stato documentato l’aumento della resistenza di Haemophilus e Branhamella alle aminopenicilline da sole).
-trattamento delle infezioni batteriche del tratto digestivo da E.coli enteropatogeno, da Shigella e Salmonella, delle febbri tifoidi e dei portatori cronici di Salmonella (ma si è notato un’aumento della resistenza di Shigella e Salmonella).
- trattamento delle infezioni biliari: amoxicillina, metampinicillina (ev), in competizione con le ureidopenicilline ed i fluorochinoloni. -trattamento dell’ulcera venerea molle: amossicillina-clavulanato (trattamento di 3 giorni in competizione con le cefalosporine di terza generazionee i fluorochinoloni).
BETA-LATTAMINE
-trattamento della listeriosi e della brucellosi nella donna incinta.-trattamento della borreliosi, leptospirosi, treponematosi.-trattamento delle pasteurellosi: aminopenicilline da sole o con amossicillina-clavulanato.-trattamento delle infezioni miste aerobi-anaerobi (addominali, ginecologiche, urinarie): amossicillina-clavulanato.-trattamento delle infezioni cutanee streptococciche o stafilococciche: aminopenicilline (streptococco),
amossicillina-clavulanato (stafilococco). -prevenzione delle endocarditi nei soggetti a rischio prima di interventi sui denti, esplorazioni genito-urinarie, broncopolmonari, gastrointestinali (colonscopia con resezione di polipi, sclerosi di varici esofagee).
Pivmecillinam , Mecillinem
Trattamento delle infezioni urinarie da enterobatteri: E. coli, Proteus mirabilis, Klebsiella, Enterobacter, Citrobacter, anche se si tratta di mutanti derepressi stabili, grandi produttori di cefalosporinasi cromosomiche di classe I. Sono stati proposti anche per il trattamento delle shigellosi, in caso di resistenza alla amoxicillina ed al cotrimoxazolo, ed in associazione con un’aminopenicillina nel trattamento delle febbri tifoidi.
Carbossipenicilline
La loro indicazione principale è il trattamento delle gravi infezioni (setticemie, meningiti, infezioni urinarie) da Pseudomonas aeruginosa, da Proteus indolo produttore naturalmente resistente alle aminopenicilline, in associa-zione con un aminoglicoside. Si utilizzano anche nel trattamento delle infezioni miste, aerobi-anaerobi, dell’addo-me o della pelvi nella donna (in associazione con un aminoside) eventualmente associate ad un inibitore delle beta-lattamasi. Siccome gli aminosidi sono inattivati dal contatto prolungato con le carbossipenicilline, i due antibiotici non devono essere mescolati nella stessa soluzione, ma somministrati separatamente ed in sedi diverse. L’associa-zione ticarcillina-acido clavulanico amplia ancor più lo spettro antibatterico e le indicazioni delle carbossipenicilline includendo anche germi secretori di beta-lattamasi.
Ureidopenicilline
Trattamento ospedaliero delle gravi infezioni:-endocarditi da enterococco (ad eccezione dell’Enterococcus faecium), in associazione con un aminoside;-meningite del neonato da streptococchi B o da Listeria (in associazione con un aminoside);-infezioni da Pseudomonas aeruginosa e da enterobatteri (in particolare da Klebsiella e da Serratia), ma anche di
infezioni polimicrobiche da germi aerobi-anaerobi sia in monoterapia (infezioni pelviche ed intraddominali), sia associate ad un’inibitore delle beta-lattamasi e ad un aminoglicoside come nelle infezioni da Pseudomonas (mucoviscidosi), setticemie a partenza gastroenterica o urinaria, infezioni in pazienti immunodepressi, per preve-nire la comparsa di resistenze batteriche in corso di trattamento. Come per le carbossipenicilline, si è proposta la loro associazione con altri inibitori delle beta-lattamasi (tazobactam, sulbactam) al fine di allargare lo spettro antibatterico e le indicazioni cliniche ai germi scarsi produttori di beta-lattamasi resistenti alle ureidopenicilline da sole.
In tutte le loro indicazioni, le carbossipenicilline e le ureidopenicilline entrano in competizione con le cefalosporine di terza e quarta generazione.
Temocillina
Si utilizza per il trattamento delle gravi infezioni da enterobatteri, grandi produttori di beta-lattamasi plasmidiche a spettro allargato.
Penicilline antistafilococciche
Trattamento delle infezioni da stafilococco produttore di penicillinasi, ad eccezione dello stafilococco meticillino-resistente: setticemie, endocarditi, pleuriti, infezioni osteoarticolari, meningiti da stafilococco, infezioni stafilococciche cutanee e mucose. Profilassi delle infezioni postoperatorie in chirurgia ortopedica, profilassi delle infezioni in neurochirurgia, dopo il posizionamento di valvole per derivazioni del liquor. In caso di insufficienza renale preferire la nafcillina (eliminazione prevalentemente biliare). Le penicilline antistafilococciche possono essere associate ad un aminoglicoside, alla fosfomicina, alla rifampicina, ai fluorochinoloni, al probenicid. Alcune volte è possibile attuare l’associazione di due penicilline deboli indutrici delle beta-lattamasi è qualche volta utilizzata: -penicillina antistafilococcica + ureidopenicillina: allargamento dello spettro antibatterico, competizione sulla
secrezione tubulare con aumento reciproco dei tassi sierici e dell’AUC. -Aminopenicillina o ureidopenicillina + cef 3 (meningite neonatale) al fine di coprire le 3 eziologie batteriche
possibili in queste età: streptococco B, enterobatteri, Listeria, fino a quando non sarà identificato il germe causale. Per il trattamento delle infezioni stafilococciche le penicilline antistafilococciche (spettro ristretto) sono preferite alle cefalosporine di prima generazione, a spettro più ampio.
Controindicazioni
Allergia alle penicilline; per le aminopenicilline, le
ureidopenicilline ed il pivmecillinam le
controindicazioni sono:
mononucleosi infettiva, associazione con allopurinolo.
Penicillina V, polvere orale: intolleranza al latte vaccino.
Precauzioni d’uso
L’anamnesi deve vertire soprattutto sulle precedenti somministrazioni. In caso di insufficienza renale adattare la dose in funzione della creatininemia, ad eccezione delle penicilline ad eliminazione prevalentemente epato-biliare (nafcillina, apalcillina). Non somministrare le penicilline antistafilococciche e l’apalcillina (fortemente legate alle proteine plasmatiche) nei neonati: rischio di ittero neonatale. In caso di trattamento prolungato con carbossipenicilline sorvegliare gli elettroliti (potassiemia). Prudenza nel corso dell’allattamento (sospendere l’allattamento?).
Interazioni farmacologiche
Interazioni utili (Tabella 3.8 e 3.9) Con altri antibiotici -con gli aminoglicosidi, sinergia (permeabilizzazione della parete batterica da parte delle beta-lattamine con
facilitazione dell’accesso dell’aminoglicoside sui siti batterici): stafilococchi, enterococchi, Listeria, enterobatteri,
Pseudomonas (ma attenzione: non mescolarli nella stessa soluzione), ad eccezione dell’imipenem.
-con la fosfomicina: penicilline antistafilococciche (stafilococchi meticillino-resistenti).
-con l’acido clavulanico, sulbactam, tazobactam: per i germi produttori delle beta-lattamasi: aminopenicilline, carbossipenicilline, ureidopenicilline.
-penicilline anti-pseudomonas + polimixina-colistina (infezioni urinarie).
-associazione di beta-lattamine, deboli induttrici di beta-lattamasi: per esempio ureidopenicilline + ceftazidime (Pseudomonas, enterobatteri), penicilline antistafilococciche + ureidopenicilline: allargamento dello spettro antibatterico, aumento reciproco delle concentrazioni sieriche per competizione sui meccanismi di secrezione tubulare.
-penicilline antistafilococciche + glicopeptidi (vancomicina, teicoplanina), anche per gli stafilococchi meti-R e glicopeptido-resistenti.
-aminopenicilline più pivmecillinam: enterobatteri (sinergia per fissazione su PBP differenti).
-penicilline antistafilococciche + acido fusidico: sinergia + inibizione della resistenza all’acido fusidico.
-penicillina antistafilococcica + rifampicina (malgrado l’antagonismo osservato qualche volta in vitro).
-penicillina antistafilococcica + fluorochinolonico (stafilococco).
-aminopenicillina, carbossipenicillina, ureidopenicillina + fluorochinolone (enterobatteri e, per gli ultimi due far-maci, Pseudomonas): inibizione della resistenza ai chinoloni.
Per le penicilline eliminate predominantemente per secrezione tubulare, l’associazione con un fluorochinolone eli
minato anch’esso per secrezione tubulare produce per competizione un aumento reciproco dei tassi sierici.
Con altri farmaci
-con il probenecid: penicilline eliminate prevalentemente per secrezione tubulare: penicillina G, aminopenicilline, ureidopenicilline, carbossipenicilline, pivmecillinam.
-imipenem con la cilastatina (inibitore delle dipeptidasi renali, responsabili della biotrasformazione metabolica dell’imipenem).
Interazioni da evitare (Tabella 3.10, 3.11 e 3.12)
Con altri antibiotici
-penicillina G, aminopenicillina + cloramfenicolo o tetraciclina (antagonismo): meningite da pneumococco o da Listeria, soprattutto nei pazienti immunodepressi.
-penicilline deboli induttrici di beta-lattamasi: penicilline antistafilococciche, carbossi- e ureidopenicilline, pivmecillinam.
-con betalattamine induttrici potenti delle beta-lattamasi: penicillina G, aminopenicilline, cefamicina, latamoxef, imipenem, cefalosporine di prima e seconda generazione: antagonismo per induzione delle beta-lattamasi ad opera di queste ultime.
-carbossipenicilline + aminoside nella stessa soluzione di perfusione: rischio di inattivazione dell’aminoglicoside (in caso di insufficienza renale e di dosi molto elevate di carbossipenicillina).
-meticillina + aminoglicoside: aumento della nefrotossicità.
-pro-farmaci (esteri) dell’ampicillina + alcalinizzanti orali ed anti-H2: diminuzione dell’assorbimento gastroenterico dell’ampicillina.
BETA-LATTAMINE
-aminopenicilline, ureidopenicilline, pivmecillinam + allopurinolo: aumento della frequenza delle eruzioni cutanee.-meticillina, cefaloridina + diuretico dell’ansa: aumento della nefrotossicità della meticillina.-ticarcillina + ciclosporina: aumento dei tassi sierici della ciclosporina.-penicilline + penicillamina o penicillina-griseofulvina, in somministrazione sequenziale: aumento del rischio di
allergie.
Modalità di somministrazione e posologia (Tabella 3.13)
1) Penicilline a somministrazione esclusivamente parenterale: penicillina G e sue forme retard, carbossipenicilline, ureidopenicilline, sulfossipenicilline, meticillina, amdinocilline, temocillina. 2) Penicilline a somministrazione esclusivamente orale: penicillina V, dicloxacillina, bacampicillina, lenampicillina, pivampicillina, telampicillina, etacillina, pivmecillinam. 3) Penicilline a somministrazione orale e parenterale: ampicillina, amoxicillina, metampicillina, oxacillina, cloxacillina,
flucloxacillina. 4) Penicilline a somministrazione locale: meticillina (collirio). Le penicilline a somministrazione parenterale si presentano sotto forma di polvere (sali sodico, disodico o potassico) da solubilizzare estemporaneamente in acqua distillata, in soluzione clorurata o glucosata isotonica (per le aminopenicilline e la penicillina G, evitare le soluzioni glucosate il quanto il pH acido le inattiva; per le penicilline disodiche (carbossipenicilline) e la meticillina, evitare le soluzioni clorosodiche; per la piperacillina evitare le solu-zioni di bicarbonato di sodio. In caso di insufficienza renale, evitare la penicillina G potassica. Le seguenti penicilline possono essere sommini-strate sia per via endovenosa (perfusione) sia per via intramuscolare, in caso sia necessaria una posologia inferiore: penicillina G sodica o potassica, oxacillina, cloxacillina, ampicillina, amossicillina, carbossipenicilline, piperacillina. Le altre ureidopenicilline vanno somministrate eclusivamente per via endovenosa. Le penicilline G retard vanno somministrate esclusivamente per via im. La penicillina G procaina non va utilizzata nei bambini di età inferiore ai 5 anni. Per la via orale si dispone di capsule o compresse, bustine e sciroppo. Le assunzioni per via orale saranno somministrate: -a distanza dai pasti, che ostacolano il loro assorbimento, per: ampicillina, etacillina, penicillina V, penicilline
antistafilococciche -durante i pasti, che migliorano la loro tolleranza gastrica: amoxicillina/ ac. clavulanico. -indipendentemente dai pasti (biodisponibilità non influenzata dalla presenza di alimenti), per: amossicillina,
esteri pro-farmaco dell’ampicillina, pivmecillinam L’amoxicillina deve essere somministrata con un volume sufficiente di acqua considerata la sua bassa idrosolubilità. Per le penicilline a farmacocinetica dose-dipendente, per esempio piperacillina, azlocillina, mezlocillina, è opportu-no iniettarne dosi elevate ad ogni somministrazione al fine di prolungare l’emivita e di ridurre così il numero di iniezioni quotidiane. La posologia e la durata del trattamento sono funzione dell’indicazione clinica e della sensibilità del germe isolato.
Penicillina G (benzilpenicillina)
Generalità
La penicillina G è stata la prima penicillina naturale estrattiva, essa è la penicillina di riferimento. Nonostante un aumento delle resistenze di certi germi (stafilococchi, enterococchi, e più recentemente pneumococchi) la penicillina G conserva ancora molte indicazioni, soprattutto in campo ospedaliero.
Composizione chimica ed origine
Penicillina naturale estrattiva di cui si utilizza il sale sodico o potassico e, per le forme semi-retard e retard, i sali e gli esteri: penicillina G procaina, penicillina G benetamina, penicillina G benzatina.
Meccanismo d’azione
Come tutte le beta-lattamine esplica un’azione battericida tempo-dipendente per inibizione della sintesi del peptidoglicano della parete batterica grazie alla fissazione sulle PBP1a e b, 2 e 3.
Spettro d’azione antibatterico medio
Germi abitualmente molto sensibili: i rari stafilococchi non secretori di beta-lattamasi, streptococchi, pneumo-cocchi rimasti sensibili (ma di recente si è avuto un aumento di ceppi a sensibilità ridotta o resistenti alla penicillina VADEMECUM DEGLI ANTIBIOTICI
G), Neisseria (gonococchi e meningococchi non secretori di beta-lattamasi), bacilli Gram positivi (ad eccezione diNocardia): B. anthracis, Corynebacterium, Listeria, Streptobacillus moniliformis, Erysipelothrix; anaerobi Gram posi-tivi: Actinomyces, Clostridium, Fusobacterium, Peptococco e Peptostreptococco; spirochete, leptospire, Borrelia,Pasteurella multocida, Fusobacterium. Bacilli Gram negativi: Pasteurella.-Germi regolarmente, ma moderatamente sensibili: streptococco B, Streptococcus viridans, enterococchi.-Germi incostantemente sensibili (< 50% dei ceppi): stafilococchi secretori di penicillinasi (85-90% dei ceppi),
enterococchi, Proteus mirabilis.
-Germi resistenti: bacilli gram negativi: enterobatteri (resistenza naturale), Pseudomonas Acinetobacter, Bacteroides fragilis; stafilococchi meti-R, Haemophilus influenzae, Branhamella catarrhalis, Nocardia, Yersinia, Clostridium difficile; germi intracellulari: Legionella, Rickettsia, Mycoplasma, Chlamydia, Brucella, Mycobacterium.
Esiste una resistenza crociata con le altre penicilline idrolizzate dalle beta-lattamasi.
Farmacocinetica
La penicillina G non viene assorbita per via orale (idrolizzata in ambiente acido dello stomaco). In infusione ev i picchi plasmatici sono in funzione della dose: 1 milione di UI: 12-15 UI/ml; 5 milioni UI: 300-400 UI/ml; 10 milioni di UI: 600-700 UI/ml. Le penicilline semi-retard e retard danno dei tassi plasmatici più bassi ma più prolungati: penicillina procaina: 5-15 UI/ml dopo 1 milione di UI penicillina G benzatina: 1.2 UI/ml dopo 2400000 UI, con tassi residui di 0.12 UI a 2 settimane e di 0.06 UI dopo 3 settimane. Emivita plasmatica breve: 30 minuti; 6 ore per la penicillina procaina. Fissazione alle proteine plasmatiche 40-60%. Biotrasformazione metabolica ridotta: 10-15%. Volume di distribuzione (VD) 0.30 l/kg, limitato all’ambiente extracellulare. Diffusione relativamente bassa nel liquor (10% del tasso sierico), ma aumentata in corso di infiammazione meningea e con l’incremento delle dosi. Diffusione nel latte e attraverso la barriera placentare. Non si ha diffusione oculare, nè nella prostata, nè nei tessuti ossei. Eliminazione urinaria rapida (90% della dose in 24 ore) in forma attiva, non metabolizzata, per filtrazione glomeru-lare (10%) e, soprattutto, per secrezione tubulare (90%), che può essere bloccata dal probenecid. Clearance renale elevata: 300-400 ml/min. Tassi urinari elevati (300-800 µg/ml).
Tossicità ed effetti indesiderati
Molto poco tossica, la penicillina G espone soprattutto ad un
rischio di natura allergica (esantema, orticaria, edema di
Quincke, shock anafilattico) per cui è necessario un’anamnesi
clinica mirata su eventuali precedenti allergici.
Le alte posologie, soprattutto in caso di insufficienza renale,
comportano il rischio di encefalopatia metabolica (con
vulsioni, turbe della coscienza), di sovraccarico di sodio e di
ipokaliemia (soprattutto in caso di insufficienza cardiaca,
renale o di cirrosi). Episodi di leucopenia-neutropenia, anemia
emolitica, turbe della coagulazione di origine piastrini
ca, possono osservarsi in seguito a trattamenti prolungati ad alte
dosi e in caso di insufficienza renale.
Reazioni tipo Herheimer possono osservarsi nel trattamento iniziale
della sifilide e delle borreliosi (prevenibili som
ministrando dosaggi incrementali).
Per iniezione im la penicillina procaina può provocare una breve
ischemia cerebrale per embolia dei cristalli di
procaina (sindrome di Hoigny) che si manifesta con un breve malore
rapidamente reversibile.
Indicazioni cliniche
La penicillina G sodica si usa soprattutto in ospedale, le
penicilline G semi-retard e retard si utilizzano in ammalati
ambulatoriali.
-Trattamento delle infezioni da pneumococchi rimasti sensibili:
otiti (ma la resistenza è aumentata di recente),
polmoniti ed ascessi polmonari, setticemia, meningite -trattamento delle meningiti meningococciche -trattamento delle endocarditi da streptococchi e da enterococchi (associata ad un aminoside) -trattamento dell’erisipela e dell’erisipeloide di Rosenbach -trattamento delle infezioni da anaerobi Gram positivi: gangrena gassosa (Clostridium), fascite necrotizzante,
actinomicosi. -trattamento del carbonchio -trattamento delle spirochetosi, leptospirosi, borreliosi. Le penicilline G semi-retard sono utilizzate nel trattamento ambulatoriale delle infezioni di media gravità e nella sifilide. La penicillina G retard (benzatina-penicillina) è utilizzata soprattutto nel trattamento delle treponematosi, nella prevenzione delle recidive del reumatismo articolare acuto e nella prevenzione delle infezioni da pneumococchi in pazienti asplenici e con drepanocitosi (associate al vaccino anti-pneumococcico).
BETA-LATTAMINE
Controindicazioni
Allergia alle penicilline (nel 5-10% dei casi si ha allergia crociata con le cefalosporine).
Precauzioni d’uso
Rischio aumentato di reazioni allergiche per somministrazione associata con prodotti di origine comune: griseofulvina, penicillamina. In caso di insufficienza renale, correggere la posologia in funzione della creatininemia. In caso di posologie alte, occorre prudenza nei pazienti cardiopatici, ipertesi, edematosi, cirrotici, con insufficienza renale (a causa dell’apporto aggiuntivo di sodio o di potassio).
Interazioni farmacologiche
Interazioni utili
-con gli aminosidi (ma bisogna somministrarli separatamente): sinergia su streptococchi, enterococchi, Listeria, etc.-con il probenecid: aumento dei tassi plasmatici e nel liquor, aumento della emivita della penicillina.Interazioni da evitare-con il cloramfenicolo: antagonismo nel trattamento di alcune meningiti (pneumococco, Listeria)
-con gli aminoglicosidi, perfusi insieme nello stesso set di infusione (inattivazione dell’aminoside dalla penicillina G), soprattutto in caso di insufficienza renale e di perfusione di lunga durata, rischio aumentato di allergia per gli aminosidi contenenti sulfiti.
Modalità di somministrazione e posologia
Penicillina G sodica o potassica: flaconi da 1000000 di UI: -Dose media: 50000-100000 UI Kg/die=3-6 milioni UI al giorno ev o im. Nelle infezioni severe si può aumentare fino a 500.000 UI Kg/die in 3-4 somministrazioni. -Alte dosi: 500000 UI Kg/die, ossia 30-50 milioni UI/die ev (perfusione ad intervalli di 1-6 ore o perfusione conti
nua (endocardite, meningite). -Bambini: dosi medie: 50000-100000 UI Kg/die; alte dosi: 250000 UI Kg/die (non superare 20000 UI al giorno). -Somministrazione locale: intrapleurica, intra-articolare. Procaina penicillina G: flaconi da 1200000 UI (associata a penicillina sodica e benzatinica: 1.2-2.4 milioni UI al giorno). Benzatina penicillina G: flaconi da 0.6, 1.2 milioni UI in iniezioni im ogni 2-4 settimane.
Penicillina V (Fenossimetilpenicillina)
Generalità
Prima penicillina orale naturale, estrattiva, analoga della penicillina G.
Proprietà fisico-chimiche
Si utilizza la penicillina V acida (compresse, polvere), il sale di potassio o la benzatina-penicillina V come sospensione orale. Spettro d’azione simile a quello della penicillina G, ma meno attiva sui gonococchi e sugli pneumococchi a sensibilità ridotta, per un’indice di inibizione più debole a causa di tassi plasmatici più bassi.
Farmacocinetica
Stabile nell’ambiente acido dello stomaco con assorbimento gastroenterico pari al 50-60% che si riduce in presenza di alimenti. Picchi plasmatici di 4-6 µg/ml per la penicillina V acida o potassica, di 3-4.5 µg/ml per la benzatina penicillina V. Emivita plasmatica breve: 30 minuti per la penicillina V potassica, 2 ore per la benzatina penicillina V. Legame alle proteine plasmatiche: 55%. Metabolizzata in misura maggiore rispetto alla penicillina G (30-50%) la penicillina si ritrova anche sotto forma di metaboliti attivi (acido penicilloico). Eliminazione renale di circa il 30%, sotto forma attiva, nelle urine delle 24 ore, per filtrazione glomerulare e secre-zione tubulare. Tassi urinari: 100-400 µg/ml. Scarsa eliminazione biliare: 1-3%.
Tossicità ed effetti indesiderati
(vedi penicillina G)
La polvere orale, che contiene come eccipiente latte scremato in
polvere, può provocare intolleranza alle proteine
del latte vaccino.
Indicazioni cliniche
L’indicazione principe è il trattamento delle angine streptococciche. Si può utilizzare anche per la profilassi delle recidive del reumatismo articolare acuto, ma si preferisce per quest’ultima la benzatina penicillina G im.
Controindicazioni
(vedi penicillina G)
In più, intolleranza alle proteine da latte vaccino.
Interazioni farmacologiche
Interazioni utili
Con il probenecid: aumento del tasso plasmatico e dell’emivita della
penicillina V.
Con gli inibitori delle beta-lattamasi, per i germi
beta-lattamasi produttori (tuttavia, questa associazione non è
attualmente utilizzata).
Interazioni da evitare
Con la neomicina orale assunta contemporaneamente (inibizione
dell’assorbimento gastroenterico della penicillina V).
Modalità di somministrazione e posologia
Compresse da 1000000 UI di penicillina V acida.Posologia media: 2000-4000 UI/die in tre-quattro somministrazioni, preferibilmente lontano dai pasti.Durata del trattamento (angina streptococcica): 10 giorni.
Penicilline antistafilococciche
Generalità
Poco tempo dopo il largo uso delle penicilline naturali estrattive, G e V, la rapida comparsa di resistenza da parte degli stafilococchi alle penicilline, per produzione di beta-lattamasi, ha portato alla ricerca e scoperta delle prime penicilline resistenti all’idrolisi operata dalla beta-lattamasi, le penicilline anti-stafilococciche.
Composizione chimica ed origine
Penicilline semi-sintetiche, a partire dall’acido 6-aminopenicillanico (6-APA): -isossazolilpenicilline: oxacillina, cloxacillina, flucloxacillina.
Spettro d’azione e resistenza batterica
Spettro antibatterico ristretto, limitato ai cocchi gram positivi: streptococchi (salvo di gruppo D), stafilococchisecretori o meno di penicillinasi (MIC 0.2 µg/ml), ad eccezione dello Staphlylococcus aureus meti-R, degli stafilo-cocchi coagulasi-negativi (S. epidermidis, S. emoliticus) e degli enterococchi, il cui meccanismo di resistenza èindipendente dalle beta-lattamasi. Questa resistenza eterogena, intrinseca degli stafilococchi meti-R ospedalieri(circa 20%) è dovuta all’acquisizione di una PBP-2a ad affinità molto ridotta per le penicilline. Esiste resistenzacrociata con le cefalosporine e spesso multiresistenza di questi germi ad aminosidi, macrolidi, glicosamidi, fluoro-chinoloni. Gli streptococchi-pneumococchi e gli anaerobi Gram-positivi, così come i bacilli Gram-postivi (Listeria) ei treponemi-leptospire-borrelia, sensibili alla penicillina G, sono egualmente sensibili alle penicilline anti-stafilococciche, ma a MIC più alte rispetto a quelle della penicillina G. Le Neisserie sono poco sensibili.Germi resistenti: enterobatteri (resistenza naturale), H. influenzae, Pasteurella, Yersinia, Bacteroides, Nocardia, Pseu-domonas, Acinetobacter.
È inoltre, importante menzionare l’associazione antibiotica a largo spettro costituita da due penicilline semisintetiche:l’ampicillina e la cloxacillina.L’ampicillina, dotata di uno spettro d’azione assai ampio e comprendente germi sia gram positivi che gram negativi,è particolarmente indicata nelle infezioni sostenute da gram negativi insensibili alla penicillina G, pur non offrendoparticolari vantaggi in quelle da germi ad essa sensibili. Non è attiva nei confronti degli stafilococchi penicillinasi-produttori e quindi scarsamente sensibile anche alla penicillina G.Per completare il campo di azione, l‘ampicillina è stata quindi associata con la cloxacillina antibiotico selettivamen-te efficace nelle infezioni sostenute da stafilococchi penicillasi-produttori. Pertanto, per sommazione di effetti e inparte per sinergismo l’associazione è in grado di esplicare un’attività battericida a largo spettro, risultando attivo intutte le più comuni infezioni di origine batterica.
BETA-LATTAMINE
Farmacocinetica
Assorbimento gastroenterico rapido, migliore a digiuno (ostacolato dalla presenza di alimenti), ma incompleto: 50% per l’oxacillina, 70% per la cloxacillina, 80% per la dicloxacillina. Emivita breve (0.5-1 ora), ad eccezione della flucoxacillina (2 ore). Picchi sierici dopo 500 mg per via orale: 4-5 µg/ml per l’oxaciclina, 8 µg/ml per la nafcillina, 9 µg /ml per la cloxacillina e 15 µg/ml per la dicloxacillina e per la flucloxacillina. Per via im (oxacicllina) i picchi sierici sono di 11 µg/ml; per via ev sono di 40 µg/ml. Forte legame con le proteine plasmatiche (> 90%); biotrasfor-mazione metabolica scarsa (20-30%), ad eccezione della nafcillina (60-70%). Volume di distribuzione (VD) ridotti: 0.10-0.15 l/kg, limitato allo spazio extracellulare. Buona diffusione placentare e nel liquido amniotico; diffusione ridotta nel liquor. Escrezione urinaria: 20-30% per l’oxacicillina e per la nafcillina, 50-60% per la cloxacillina, 70-80% per la dicloxacillina, nelle urine delle 24 ore (per filtrazione glomerulare e secrezione tubulare). Tassi urinari alti (> 1000 µg/ml). Concentrazione ed eliminazione per via biliare, soprattutto con la nafcillina che è eliminata per circa l’80% attraverso questa via. Sia l’ampicillina che la cloxacillina in associa-zione raggiungono concentrazioni ematiche rapide ed elevate sia per os che per via parenterale. Per l’ampicillina il picco ematico viene raggiunto dopo un’ora con concentrazioni sieriche attive per 6 ore. L’eliminazione avviene con le urine e con la bile in forma attiva. Solo il 18% circa è legato alle proteine plasmatiche. Per la cloxacillina il picco ematico viene raggiunto dopo circa 30 min. con concentrazioni sieriche attive per 4 ore; l’eliminazione in forma attiva avviene per via urinaria e biliare. Il legame con le proteine plasmatiche è superiore al 90%.
Tossicità ed effetti indesiderati
(vedi penicillina G) Reazioni particolari alle penicilline antistafilococciche sono: reazioni epatiche (colestasi), soprattutto ad alte dosi ed in caso di associazione con altri prodotti epato-tossici. Rischio di ittero nucleare nei lattanti e nei neonati per competizione con la bilirubina nella fissazione alle proteine. L’associazione ampicillina-cloxacillina somministrata per 180 giorni a dosi crescenti di 10 e 20 volte superiori a quelle terapeutiche, non ha provocato variazioni significative sulle costanti bioumorali nè sulle strutture e sul funzionamento dei principali organi, nè sull’accrescimento ponderale e su altri parametri presi in esame. Non sono stati evidenziati, inoltre, effetti teratogeni del farmaco.
Indicazioni cliniche
Sono limitate alle infezioni da stafilococchi meti-S, ovunque localizzate.
Controindicazioni e precauzioni d’uso
(vedi penicillina G)
In caso di insufficienza renale ridurre la posologia, soprattutto in
caso di somministrazione parenterale (ad eccezio
ne della nafcillina).
Interazioni utili
Con la fosfomicina (anche sugli stafilococchi meti-R), con l’acido
fusidico (ma aumentato rischio di colestasi), con
la rifampicina (sinergia più inibizione delle resistenze
batteriche), con il probenecid (aumento dei tassi plasmatici e
dell’emivita della penicillina, per competizione nella secrezione
tubulare).
Modalità di somministrazione e posologia (Tabella 3.13).
Oxacillina: Terapia parenterale, fiale da 1 g; A: 250-500 mg ogni 6 ore; B: 25-50 mg/kg/die Flucloxacillina: Terapia orale; cpr da 500 e 1000 mg; A: 1 cpr ogni 6 ore oppure 1 cpr ogni 6-8 ore; B: 1 cpr oppure 1/2 cpr ogni 8 ore. Terapia parenterale; fiale da 1 g; A: 1 fl ogni 8 ore im; B: fino a 100 mg/kg/die in dosi refratte, non superare la dose di 33 mg/kg. Ampicillina + cloxacillina: Terapia orale; cps da 375 mg; A: 1-2 cps ogni 4-6 ore. Terapia parenterale; flaconi da 300-600-1000 mg; Adulti e bambini: 2-3 flaconi al giorno, secondo prescrizione medica. Nelle infezioni gravi, la posologia può essere aumentata, a giudizio del medico, senza tema di effetti indesiderabili.
Aminopenicilline
Generalità
Penicilline a largo spettro, molto usate sia in ambiente ospedaliero (per somministrazione soprattutto parenterale)che nel trattamento ambulatoriale per via orale.Tuttavia, l’aumento recente delle resistenze degli enterobatteri e dell’Haemophilus per produzione di beta-lattama-si plasmidiche richiede a volte l’associazione con un inibitore di queste ultime.
Composizione chimica ed origine
Penicilline semisintetiche a largo spettro. Si utilizzano sia l’ampicillina, sia i suoi pro-farmaci, per esterificazione del gruppo carbossilico dell’ampicillina (bacampicillina, lenampicillina, pivampicillina, talampicillina, etacillina, metampicillina), sia l’amoxicillina.
Spettro d’azione
Rispetto alla penicillina G, le aminopenicilline includono:
-i cocchi Gram positivi: stafilococchi meti-S non secretori di penicillinasi, streptococchi, pneumococchi, anche quelli con sensibilità ridotta alla penicillina G (a condizione di aumentare la posologia), Enterococcus fecalis e E. faecium;
-i bacilli Gram positivi: Corynebacterium, Listeria, B. anthracis, Erysipelotrix;-gli enterobatteri scarsi produttori di beta-lattamasi: E. coli, Proteus mirabilis, Salmonella, Shigella, Campylo-
bacter; -gli anaerobi Gram positivi: Clostridium perfrigens, Peptococcus e Peptostreptococcus, Actinomyces -anaerobi Gram negativi: Fusobacterium. Sono parimenti sensibili: H. influenzae e Branhamella catarrhalis non secretore di penicillinasi, Bordetella, Pasteurella, Eikenella, Gardenerella vaginalis, Helicobacter pylori, Vibrio cholerae, Treponema, Leptospire e Borrelia. Attualmente, tra questi germi, si riscontra una percentuale variabile di resistenza alle aminopenicilline: H. influen-zae (30%) H. ducreyi (90%), Branhamella catarrhalis (80%), Vibrio cholerae (80%), Staphylococcus secretore di penicillinasi (90%), pneumococchi a sensibilità diminuita o resistenti alla penicillina G (10-15% in Francia), E. coli (30%), Proteus mirabilis (10-15%), Shigella (30%), Salmonella (10%), Campylobacter (50%), gonococco secretore di penicillinasi (15%). Resistenza naturale per Klebsiella, Enterobacter, Citrobacter, Serratia, Proteus indolo produttore, Providencia, Yersinia. Resistenza degli stafilococchi produttori di penicillinasi come Pseudomonas, Acinetobacter, Alcaligenes, Bacteroides, Clostridium difficile, Nocardia (il solo bacillo Gram positivi non sensibile alle aminopenicilline) e di tutti i germi intracellulari senza parete (vedi penicillina G). Esiste una qualche differenza nello spettro antibatterico comparativo ampicillina-amoxicillina: l’ampicillina è più attiva su Shigella, l’amoxicillina è più attiva sulle salmonelle e gli pneumococchi a sensibilità diminuita.
Farmacocinetica
La farmacocinetica delle aminopenicilline è dose-dipendente negativa: l’aumento delle dosi provoca una riduzione dell’emivita plasmatica, un aumento della frazione libera non legata alle proteine ed una eliminazione più rapida. L’ampicillina è scarsamente assorbita per via gastroenterica (30-40%) e l’assorbimento è soggetto a grandi varia-zioni individuali ed è ridotto in presenza di alimenti; tale assorbimento viene nettamente migliorato con l’associa-zione del sulbactam. Gli esteri dell’ampicillina: bacampicillina, lenampicillina, pivampicillina e talampicillina si assorbono quasi comple-tamente per via gastroenterico indipendentemente dalla presenza o meno di alimenti. L’amoxicillina ha un assorbi-mento gastroenterico quasi completo (>80%) non è influenzato dalla presenza di alimenti. I picchi plasmatici sono in funzione della dose e della via di somministrazione: -ampicillina 500 mg: via orale, picchi sierici 3-4 µg/ml; im: 15-18 µg/ml; iv 50 µg/ml -amoxicillina: 500 mg: (via orale) 7-10 µg/ml, 1000 mg: 17 µg/ml; im 500 µg: 11 µg/ml, 1000 mg: 22 µg/ml; iv
500 mg: 110 µg/ml, 1000 µg: 185 µg/ml. La concentrazione linfatica è elevata, e questo spiega l’attività delle aminopenicilline nel trattamento della febbre tifoide. L’emivita plasmatica è breve ed è pari a circa 1 ora. Il legame alle proteine plasmatiche è scarso, di circa il 20%. Il volume di distribuzione (VD) è di 0.20-0.30 l/kg ed è limitato agli spazi extracellulari. Gli antibiotici diffondono attraverso la barriera placentare e nel latte materno. Si ha una diffusione relativamente scarsa nel liquor, migliore in caso di infiammazione meningea. Le concentrazioni nel liquor di 3-10 µg/ml in caso di meningite, efficace per germi molto sensibili aventi una MIC molto bassa. La biotrasformazione metabolica è molto scarsa (< 20%), l’eliminazione avviene sotto forma attiva con le urine (90%) per filtrazione glomerulare (20%) e per secrezione tubulare (80%) e nella bile (10% per l’amoxicillina, 20% per l’ampicillina). Il probenecid fa aumentare il tasso plasmatico, l’emivita e l’AUC per blocco della secrezione tubulare. Le concentrazioni urinarie sono alte (> 1000 µg/ml), la clearance totale è pari a 300-350 ml/min, la clearance renale è uguale a 250-300 ml/min. In caso di insufficienza renale, diminuzione della posologia in funzione della creatininemia. Emodializzabile.
BETA-LATTAMINE
Tossicità ed effetti indesiderati
(vedi penicillina G) Una reazione particolare alle aminopenicilline è la comparsa di eruzioni cutanee maculo-papulari non orticaroidi di origine non immunologica, a comparsa più tardiva e reversibili anche se si continua il trattamento. Esse sono particolarmente frequenti in corso di mononucleosi infettiva (per prudenza, evitare di trattare le angine con le aminopenicilline), da Cytomegalovirus, in presenza di leucemia linfoide cronica e di iperuricemia trattata con allopurinolo. Possono sopravvenire delle sovrainfezioni sostenute da germi insensibili alle aminopenicilline: Kleb-siella, Pseudomonas, Candida.
Indicazioni cliniche
Le indicazioni delle aminopenicilline da sole sono attualmente molto limitate a causa del continuo aumento delle
resistenze di alcuni germi: H. influenzae, Branhamella catarrhalis, Neisseria, E. coli, etc. Per contro, indicazioni
nuove sono valide per altri germi quali l’Helicobacter pylori non inducendo resistenza batterica in quest’ultimo
microrganismo.
-Trattamento delle meningiti purulente dei neonati e dei bambini sostenute da Streptococco di gruppo B, H. influenzae o Listeria, i tre germi più frequentemente in causa in questa fascia di età.
-Trattamento delle meningiti purulente dell’adulto da meningococco o pneumococco sensibili. Quando si tratta di uno pneumococco a sensibilità ridotta, ricorrere ad un aumento della posologia o ad una cefalosporina di terza generazione o ad un glicopeptide.
-Trattamento delle endocarditi da Streptococcus viridans o da Enterococcus, in associazione con un aminoglicoside.
-Trattamento delle setticemie da bacilli Gram negativi sensibili.
-Trattamento ambulatoriale delle infezioni ORL: otiti, sinusiti, etc (si preferiscono attualmente le associazioni con un inibitore delle beta-lattamasi).
-Trattamento delle infezioni bronco-polmonari da germi sensibili, ad eccezione di quelle provocate da germi intra-cellulari privi di parete: Chlamydia pneumoniae, Mycoplasma pneumoniae, Legionella, micobatteri.
-Trattamento delle infezioni delle basse (associare eventualmente un inibitore delle beta-lattamasi) e delle alte vie urinarie, in associazione con un aminoglicoside.
-Trattamento delle infezioni batteriche del tratto gastroenterico sostenute da E. coli, Salmonella (infezioni siste-miche e portatori sani), Shigella (ma attualmente si preferisce ricorrere in ragione della frequenza delle resisten-ze, ad un fluorochinolone o al cotrimossazolo).
-Trattamento delle infezioni epato-biliari e delle infezioni del liquido ascitico nei cirrotici: aminopenicilline + inibitore delle beta-lattamasi.
-Trattamento della gonorrea, ad eccezione delle infezioni gonococche faringee ed ano-genitali: amoxicillina + probenecid
-Trattamento dell’ulcera venerea molle: amoxicillina-clavulanato
-Trattamento della listeriosi e della brucellosi nella donna gravida
-Trattamento delle leptospirosi, borreliosi (fase primaria e secondaria) e treponematosi
-Trattamento delle pasteurellosi
-Trattamento delle infezioni cutanee streptococciche
-Profilassi delle endocarditi nei soggetti a rischio, prima di manovre invasive dentarie, genito-urinarie, broncopolmonari e gastroenteriche (sclerosi delle varici esofagee).
L’associazione ampicillina + sulbactam, quando effettivamente indicata, può essere somministrata anche in corso
di gravidanza o durante l’allattamento, sotto il diretto controllo medico.
Interazioni farmacologiche
Interazioni utili
-Con la claritromicina: eradicazione di H. pylori, infezioni respiratorie (per coprire i germi intracellulari);
-con il nitromidazolo: H. pylori;
-con gli aminosidi: enterococchi, enterobatteri, Listeria;
-con le cefalosporine di terza generazione: meningiti neonatali, (streptococco di gruppo B, enterococco, enterobatteri, Listeria);
-con il cotrimossazolo: Listeria (meningo-encefalite);
-con gli inibitori delle beta-lattamasi: H. influenzae e ducrey, Branhamella catharralis, Neisseria, Bacteroides e enterobatteri produttori di beta-lattamasi;
-con il probenecid: gonococchi, meningiti batteriche, endocarditi, fluorochinoloni eliminati per secrezione tubulare (aumento reciproco dei tassi plasmatici e liquorali per meccanismo competitivo).
Interazioni da evitare -Allopurinolo, tisopurina: alto rischio di reazioni cutanee; -Cloramfenicolo, tetracicline: rischio di antagonismo; -Clorochina: inibizione del riassorbimento gastroenterico delle aminopenicilline; -Griseofulvina, penicillamina: rischio aumentato di allergia. -Alcalinizzanti (topici digestivi, anti-H2, inibitori della pompa protonica): esteri dell’ampicillina (pro-farmaci): inibizione del riassorbimento gastroenterico delle aminopenicilline.
Modalità di somministrazione e posologia
Le aminopenicilline possono somministrarsi per via orale o parenterale:-per via esclusivamente orale: esteri dell’ampicillina: bacampicillina, pivampicillina, talampicillina;-via orale e parenterale (ev, im): ampicillina, amoxicillina, ampicillina + sulbactam;-per somministrazione parenterale, evitare le soluzioni glucosate;-l’assunzione per via orale sarà facilitata da un volume di acqua sufficiente;-per l’ampicillina, le assunzioni devono avvenire lontano dai pasti, i quali ostacolano l’assorbimento gastroenterico-L’amoxicillina-clavulanato va assunto durante i pasti per evitare l’intolleranza gastroenterica-per l’amoxicillina e gli esteri pro-farmaci dell’ampicillina le assunzioni possono avvenire in qualsiasi momento.-La posologia media nell’adulto per il trattamento ambulatoriale è di 2 g/die (ampicillina), di 1 g/die (ampicillina,
bacampicillina) . Per via parenterale le posologie sono le stesse per tutte le aminopenicilline; posologie elevate (fino a 10-12 g/die) possono essere sfruttate per il trattamento delle meningiti, delle endocarditi e delle setticemie. Forme farmaceutiche disponibili in Italia: -ampicillina: cps da 250, 500 e 1000 mg; gocce pediatriche; fiale im da 250, 500 e 1000 mg. -bacampicillina: cpr da 800 e 1200 mg -amoxicillina: cpr da 250, 500 e 1000 mg; cps da 500 mg; fiale im da 500 mg e 1 g.; sospensione orale. -amoxicillina-clavulanato: cpr da 1 g; bustine da 312.5 mg ed 1 g; sospensione pediatrica; fiale ev da 1200 e 2200 mg. -ampicillina-sulbactam: fiale im e/o ev somministrabili negli adulti ad un dosaggio compreso tra 3 e 12 g. Il dosaggio
raccomandato nei bambini è di 50 mg/kg/die di sulbactam e di 100 mg/kg/die di ampicillina.
Amdinopenicilline (Mecillinam, Pivmecillinam)
Generalità
Beta-lattamine a spettro ristretto e limitato ad alcuni enterobatteri. Fissazione sulle PBP 2 in maniera differente rispetto a quelle delle altre penicilline (PBP1 e 3).
Spettro d’azione
Specie abitualmente molto sensibili: E. coli, Salmonella, Shigella. Contrariamente alle aminopenicilline, Klebsiella, Yersi-nia, Enterobacter, Citrobacter sono egualmente molto sensibili, ad eccezione dei ceppi grandi produttori di beta-lattamasi.Specie regolarmente, ma moderatamente sensibili: Proteus mirabilis.Specie irregolarmente sensibili: Proteus indolo-produttore, Providencia, Serratia.Specie resistenti: Cocchi e bacilli Gram positivi, Neisseria, H. Influenzae, Pseudomonas, Acinetobacter, anaerobiGram positivi e Gram negativi.La resistenza non è crociata con le aminopenicilline e si ha spesso una sinergia d’azione sui germi sensibili.
Farmacocinetica
Pivmecillinam: buon assorbimento per via gastroenterica (75%) indipendentemente dalla presenza di cibo. Tasso plasmatico: 4-5 mg/ml (dopo 400 mg); emivita breve; debole legame con le proteine plasmatiche (10-15%); biotra-sformazione metabolica ridotta (circa 20%); eliminazione urinaria rapida, sotto forma attiva; tasso urinario di 60-120 µg/ml; eliminazione e concentrazione biliare, che aumenta in caso di insufficienza renale. Mecillina ev 200 mg: picchi sierici di12 µg/ml; 600 mg: 50 µg/ml; im 200 mg: 6 µg/ml.
Tossicità ed effetti indesiderati
(vedi penicillina G)
Come per le aminopenicilline, esiste un aumentato rischio di
reazioni cutanee in caso di mononucleosi infettiva,
infezioni da CMV, leucemia linfoide cronica ed assunzione di
allopurinolo.
BETA-LATTAMINE
Precauzioni d’uso
Ridurre la posologia in caso di insufficienza renale.
Indicazioni cliniche
Per via orale, soprattutto nel trattamento delle infezioni urinarie, ad eccezione di quelle da Proteus. Sono state proposte anche per il trattamento delle salmonellosi, dei portatori di salmonella in associazione con le aminopenicilline, e delle Shigellosi.
Interazioni farmacologiche
Interazioni utili
-con le aminopenicilline;
-con gli inibitori delle beta-lattamasi;-con il probenecid.Interazioni da evitare-allopurinolo, tissopurina.
Carbossipenicilline
Generalità
Penicilline semisintetiche a largo spettro.
La prima carbossipenicillina, la carbenecillina, non è più
utilizzata attualmente, essendo stata rimpiazzata dalla
ticarcillina, da sola od associata ad un inibitore delle
beta-lattamasi.
Proprietà fisico-chimiche
Penicilline dianioniche, deboli induttrici delle beta-lattamasi, ma idrolizzate dalle beta-lattamasi in assenza di un inibitore di queste ultime. Si utilizzano i soli sali disodici.
Spettro d’azione
-Molto ampio. In rapporto alle aminopenicilline, esse includono in più:
-gli enterobatteri produttori di cefalosporinasi: Enterobacter (irregolarmente sensibile), Citrobacter (irregolar-mente sensibile), Proteus indolo-positivo, Providencia, Pseudomonas, Acinetobacter (irregolarmente sensibile), Bacteroides.
-resistenza frequente di Enterobacter (30%), Pseudomonas (30%), Proteus (10-40%), E. coli e Proteus mirabilis (15-20%), Citrobacter e Serratia (50%), Providencia (75%), Acinetobacter (755), Bacteroides (15-30%).
-Germi resistenti: Yersinia, Nocardia, Klebsiella, Branhamella catarrhalis, Burkholderia (Pseudomonas) cepacea, Xanthomonas, Enterococco, stafilococchi meti-S e Meti-R produttori di penicillinasi, così come le Enterobacteriacae produttori di cefalosporinasi di classe I e di beta-lattamasi a spettro allargato (Klebsiella) e i germi intracellulari senza parete (vedi penicilline). In rapporto alle aminopenicilline ed alle ureidopenicilline, l’attività è inferiore sugli enterococchi, sugli enterobatteri non produttori di beta-lattamasi e sui Bacteroides; questa minore attività è compensata da un’azione battericida più rapida e da un effetto inoculo meno pronunciato.
Associata ad un inibitore delle beta-lattamasi, lo spettro di attività della ticarcillina si estende agli enterobatteri produttori di beta-lattamasi ed aumenta la sua attività sugli altri germi produttori di beta-lattamasi: stafilococco meticillino-sensibile, enterobatteri resistenti alla ticarcillina da sola. La ticarcillina conserva la sua attività sui germi sensibili alle aminopenicilline (eccetto gli enterococchi: bacilli Gram positivi (Corynebacterium, Listeria); bacilli Gram positivi negativi (E. coli, Salmonella, Shigella, H.influenzae) non produttori di beta-lattamasi (Fusobacterium, Peptococco e Peptostreptococco).
Farmacocinetica
Lineare: i tassi plasmatici, l’emivita e l’AUC, la clearance renale, aumentano proporzionalmente alle dosi sommi-nistrate. La somministrazione ev (5 g) dà picchi sierici di 250-300 µg/ml; ev (2 g): picchi sierici di 110 µg/ml; im(1g) 30 µg/ml, im (2 g): 60 µg/ml.Emivita plasmatica breve (1.2 h), legame con le proteine plasmatiche: 45%.Volume di distribuzione (VD): 0.20 l/Kg.
Diffusione transplacentare e nel latte materno.Diffusione relativamente bassa nel liquor (15-20% dei tassi plasmatici). Biotrasformazione metabolica molto scarsa.Eliminazione urinaria molto rapida (95%) nelle urine delle 24 ore per filtrazione glomerulare (predominante) +secrezione tubulare (meno importante). Picchi urinari alti: 2000-5000 µg/min. In caso di insufficienza renalesevera, l’emivita si allunga considerevolmente (15 h).
Tossicità ed effetti indesiderati
(vedi penicilline)Per il fatto che si ha un grande apporto di sodio per dosi alte (1 g di ticarcillina disodica = 5.2 mEq di Na), laticarcillina deve essere utilizzata con cautela (rischio di ipokaliemia ed ipernatriemia) nei pazienti cardiopatici,ipertesi, con edema, nefropatici. Essa può provocare anche, più frequentemente delle altre penicilline, diatesiemorragiche, coagulopatie per disfunzione piastrinica o per induzione di una ipoprotrombinemia (fattori favo-renti: malnutrizione, alimentazione parenterale, etc).
Indicazioni cliniche
L’indicazione principale è il trattamento delle infezioni da Pseudomonas aeruginosa e da Proteus indolo-positivo(associata ad un aminoside).Si utilizza anche nel trattamento delle infezioni miste sostenuta da aerobi-anaerobi.L’associazione ticarcillina + acido clavulanico amplia le indicazioni cliniche alle infezioni da germi secretori di beta-lattamasi a spettro allargato ed ai germi resistenti alla ticarcillina da sola: cocchi Gram positivi (ad eccezione deglienterococchi), cocchi Gram negativi, bacilli Gram positivi, enterobatteri produttori di beta-lattamasi e resistentialle aminopenicilline e alla ticarcillina da sola [Proteus indolo-positivo, Providencia, Citrobacter, Enterobacter, Serratia,e coccobacilli Gram negativi (Haemophilus) e Bacteroides].
Precauzioni d’uso
Sorvegliare il quadro elettrolitico (kaliemia, natriemia). Adattare la posologia in caso di insufficienza renale.
Interazioni farmacologiche
Interazioni utili-con altri antibiotici anti-Pseudomonas: aminosidi (sinergia), aztreonam, ceftazidime, cefsulodina, cefoperazone,
ceph.4, fosfomicina (ma rischio di sovraccarico di sodio), fluorochinoloni, polymixina-colistina; -con altri anti-anaerobi: clindamicina, nitromidazolo. Interazioni da evitare Fosfomicina disodica (rischio di sovraccarico di sodio); beta-lattamine induttrici potenti delle beta-lattamasi: peni-
cillina G, ceph.1 e 2, cefamicina, latamoxef, imipenem (rischio
aumentato di insuccesso terapeutico e di sovrainfe
zione con germi resistenti).
Griseofulvina, penicillamina: rischio aumentato di allergia;
aminosidi in perfusione nella stessa soluzione: rischio di
inattivazione degli aminosidi con la ticarcillina.
Modalità di somministrazione e posologia
Ticarcillina: fl da 1000, 2000 e 5000 mg per somministrazione parenterale o in bolo: 250 mg/kg al giorno, (adulti)12-15 g/die in 3-6 somministrazioni/die. Bambini: 225 mg/kg/die, in 3 somministrazioni giornaliere.Pe via im flacone di 1 e 2 g (con lidocaina): 1-2 g 3 volte al giorno (infezioni urinarie).In Italia è disponibile solo l’associazione ticarcillina + ac. clavulanico in fiale da 1.2 e 3.2 g.
Ureidopenicilline
Generalità
Penicilline a largo spettro. Attualmente nella pratica clinica si usano due prodotti: piperacillina e mezlocillina (l’apalcillina e l’azlocillina non sono più utilizzate), talvolta associate ad un inibitore delle beta-lattamasi. Spettro d’azione largo, molto vicino a quello delle carbossipenicilline; tuttavia, esse presentano un’attività più incisiva sui cocchi Gram positivi (soprattutto sugli enterococchi) e sui bacilli Gram positivi, un’attività leggermente superiore sullo Pseudomonas aeruginosa e gli anaerobi Gram positivi e Gram negativi ed un’attività su Klebsiella (che è resistente alle carbossipenicilline), ad eccezione dei ceppi produttori di beta-lattamasi a largo spettro.
BETA-LATTAMINE
Questi vantaggi sono in parte neutralizzati dal fatto che le carbossipenicilline sono più resistenti all’idrolisi da partedelle beta-lattamasi. Tra le due ureidopenicilline la piperacillina è più attiva su Pseudomonas, mentre sugli altrigermi la loro attività è equivalente.Il loro spettro d’azione include quindi cocchi e bacilli Gram positivi, cocchi Gram negativi (Neisseria), H. influenzae,enterobatteri, Pseudomonas aeruginosa, Acinetobacter.Germi resistenti: stafilococchi produttori di penicillinasi, pneumococchi a sensibilità diminuita o resistenti allapenicillina, H. influenzae e Branhamella catarrhalis produttori di penicillinasi, germi intracellulari senza paretecellulare. Resistenze crociate con le altre penicilline idrolizzate dalle beta-lattamasi.
Farmacocinetica
Dose dipendente positiva: l’aumento delle dosi porta ad un aumento non lineare dei tassi plasmatici e dell’AUC, ad un aumento della emivita, ad una diminuzione del volume di distribuzione e della clearance renale. Picchi sierici: piperacillina iv (iniezione rapida); 2 g: 300 µg/ml; 4 g: 400 µg/ml; perfusione iv di 4 g: 250 µg/ml). Mezlocillina iv: 2 g: 180-200 µg/ml; 5 g: 370-400 µg/ml. Emivita plasmatica: un’ora. Legame alle proteine plasma-tiche: 20-30%; scarsa metabolizzazione (< 10%). Eliminazione urinaria (65%) per filtrazione glomerulare + secre-zione tubulare (meccanismo predominante). L’eliminazione urinaria è dose-dipendente; l’aumento delle dosi riduce l’eliminazione urinaria per saturazione dei meccanismi di secrezione tubulare. Clearance renale superiore alla clea-rance della creatinina (200-240 ml/min). Concentrazione ed eliminazione biliare (35%). Emodializzabile (circa 30%).
Tossicità ed effetti indesiderati
(vedi carbossipenicilline)
L’apporto sodico, pari a 1.85 mEq/g (sale monosodico), è inferiore a
quello delle carbossipenicilline, che sono sali
disodici.
Indicazioni cliniche
Trattamento delle infezioni da Pseudomonas aeruginosa (piperacillina) e delle infezioni da enterococchi (endocarditi, infezioni urinarie), in associazione con un aminoside; trattamento delle infezioni da enterobatteri ed anaerobi (infezioni miste plurimicrobiche addominali e genitali); trattamento delle infezioni biliari (eliminazione e concen-trazione biliare); trattamento delle infezioni del liquido ascitico (enterobatteri, enterococchi); trattamento delle meningiti neonatali (in associazione con un aminoside), trattamento delle infezioni nosocomiali, soprattutto nei pazienti immunodepressi. L’associazione con un inibitore delle beta-lattamasi le rende competitive con le cefalosporine di 3a e 4a generazione. L’associazione con un inibitore delle beta-lattamasi è particolarmente indicata per il trattamento di infezioni sostenute da germi produttori di penicillinasi.
Interazioni farmacologiche
Interazioni utili -con gli aminosidi (iniettati separatamente): sinergia per aumento da parte delle ureidopenicilline della permeabilità della parete cellulare batterica agli aminosidi; in più si ha un effetto “probenecid like” delle ureidopenicilline, per competizione sulla secrezione tubulare, che porta ad una diminuzione dell’accumulo dell’aminoside nelle cellule tubulari renali (diminuzione delle nefrotossicità degli aminosidi): enterococchi, Listeria, Enterobatteri, Pseudo-monas, Acinetobacter; -con i fluorochinoloni (stessi effetti): enterobatteri, Pseudomonas; -con la fosfomicina: enterobatteri, Pseudomonas, Serratia; -con aztreonam: sinergia + aumento dei tassi plasmatici per competizione con i meccanismi di secrezione tubula-re: enterobatteri, Pseudomonas; -con le cefalosporine anti-Pseudomonas (ceftazidima, cefsulodina, cefoperazone, cefalosporine di 4a generazione): sinergia + aumento reciproco dei tassi plasmatici per competizione sulla secrezione tubulare; -con la polimixina-colistina: Pseudomonas, Acinetobacter, Enterobatteri; -con il probenecid: aumento dei tassi plasmatici e della emivita delle ureidopenicilline, per competizione sulla
secrezione tubulare. Interazioni da evitare -con le beta-lattamine, potenti induttrici delle beta-lattamasi: cefalosporine di 1a e 2a generazione, cefamicina,
latamoxef, imipenem; -con gli aminosidi nello stesso liquido di perfusione: inattivazione dell’aminoside + aumentato rischio di allergia per la presenza di sulfiti nel falcone degli aminosidi;
-con cloramfenicolo e tetraciclina: possibile antagonismo (meningiti); -con griseofulvina, penicillina: aumentato rischio di allergia; -con l’allopurinolo: aumentato rischio di eruzioni cutanee.
Incompatibilità fisico-chimiche
-piperacillina: con le soluzioni di bicarbonato di sodio; -mezlocillina: con gli aminosidi e le tetracicline im.
Modalità di somministrazione e posologia
Somministrazione esclusivamente parenterale, in bolo iv o in perfusione lenta, oppure per via im (piperacillina). Piperacillina: fiale da 1 g, 2 g e 4 g (quest’ultima solo per uso ospedaliero). Posologia: 200 mg/kg/die, ossia in media 12 g/die in tre somministrazioni. È utile somministrare un’alta dose al fine di allungare la sua emivita (farmacocine-tica dose dipendente). Mezlocillina: flaconi da 500 e 1000 mg. Posologia: 240-300 mg/Kg/die in 2-4 somministrazioni (adulti). Nei neonati e prematuri: 160-200 mg/Kg/die. Disponibile anche l’associazione piperacillina-tazobactam in fiale da 2.25 e 4.5 g (quest’ultima formulazione solo per uso ospedaliero).
3.2 INIBITORI DELLE BETA-LATTAMASI
Generalità
È risaputo che molte beta-lattamine di utilizzo clinico hanno un certo effetto inibitorio sulle beta-lattamasi cromo-somiche (isossazolil-penicilline antistafilococciche, carbossipenicilline, latamoxef, imipenem ed aztreonam); tutta-via, tale effetto inibitorio è reversibile alla sospensione della loro somministrazione. I nuovi inibitori delle beta-lattamasi sono degli inibitori irreversibili e, benché di struttura beta-lattamica, non hanno (o hanno solo scarsamente) un’azione antibatterica propria (ad eccezione che su Neisseria e in misura minore su Acinetobacter). Tre inibitori sono attualmente utilizzati in clinica: l’acido clavulanico, il sulbactam ed il tazobactam; altri sono in corso di studio: derivati alogenati (clorati, iodati, bromati) dell’acido penicillanico, acido olivanico. etc. Gli inibitori delle beta-lattamasi possono associarsi a tutte le beta-lattamine idrolizzate dalle beta-lattamasi. Tut-tavia, nella pratica essi sono attualmente utilizzati in associazione solo con le penicilline idrolizzate dalle beta-lattamasi (aminopenicilline, ticarcillina, ureidopenicilline) e qualche volta con le cefalosporine di 3a generazione, allorquando si tratta di germi produttori di beta-lattamasi a spettro allargato (Klebsiella, etc).
Composizione chimica ed origine (Figura 3.10)
Alcuni inibitori (acido clavulanico, acido olivanico) sono degli
inibitori naturali, estratti da uno Streptomyces:-Streptomyces
clavuligerus (struttura clavam per il clavulanato);-Streptomyces
olivaceus (struttura carbapeneme) per il complesso degli acidi
olivanici.Altri inibitori si ottengono per semisintesi: sulbactam,
tazobactam, brobactam (struttura tiazolidinica legata al-l’anello
beta-lattamico).Come struttura chimica essi sono dei beta-lattamici
(penemi) sulfonati (sulbactam tazobactam, brobactam), deglioxapenemi
(clavami) o dei carbapenemi (acido olivanico).La posizione C2
si ha una sostituzione beta-idrossietilindenica (acido clavulanico) o
bimetilica (sulbactam) o
triazolilmetilica (tazobactam). Più recentemente, una doppia
esterificazione dei gruppi acidi carbossilici di una
aminopenicillina (ampicillina) e del sulbactam (sultamicillina) ha
portato alla sintesi di quello che va sotto il nome
di “mutual prodrug”, che libera i due composti, dopo somministrazione
orale, per un meccanismo di idrolisi che si
verifica nelle cellule parietali dell’intestino.
Proprietà fisico-chimiche
Tutti gli inibitori sono idrosolubili e di basso peso molecolare (200-300). Per l’acido clavulanico si utilizza il sale potassico; per il sulbactam si utilizza il sale sodico per la somministrazione parenterale mentre, per la via orale si utilizza sia l’estere pivalico (pivsulbactam) che la sultamicillina.
Meccanismo d’azione
Inibizione competitiva delle beta-lattamasi batteriche, soprattutto delle penicillinasi; in una prima tappa l’inibitore si lega al sito attivo della beta-lattamasi, in competizione con l’aminopenicillina (con cui presenta un’analogia strutturale). Nelle tappe successive l’inibitore reagisce in modo irreversibile con la beta-lattamasi (inattivazione) dando vita ad un legame covalente stabile con la beta-lattamasi inattivata.
ACIDO CLAVULANICO SULBACTAM PIVSULBACTAM
AMPICILLINA-SULBACTAM
 O O
O O
![]() CH3
S
CH3
S
![]() CHCONH
CHCONH
![]() CH3
CH3
NH![]() N
N
2
![]() COOCH2OOC
O
COOCH2OOC
O
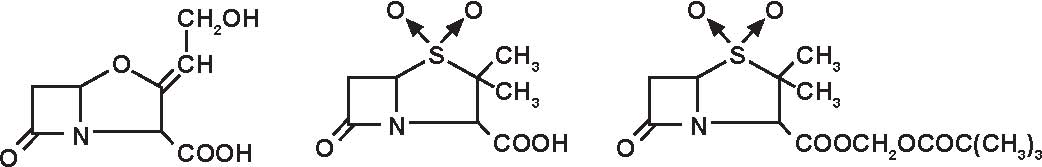
Figura 3.10 Alcuni inibitori irreversibili delle beta-lattamasi.
L’inibizione delle beta-lattamasi è ottimale a pH alcalino e diminuisce in ambiente acido. L’entità dell’inibizione è calcolata in rapporto alla diminuzione della MIC della beta-lattamina nei confronti dei batteri resistenti alle aminopenicilline, in presenza di concentrazioni variabili dell’inibitore ed alla prevenzione di un effetto inoculo delle beta-attamine idrolizzate dalle beta-lattamasi. Lo spettro di inibizione delle beta-lattamasi è più o meno comune per i diversi inibitori; essi inibiscono soprattutto le penicillinasi plasmidiche e cromosomiche: classe II (penicillinasi cromoso-miche), classe III (beta-lattamasi plasmidiche a largo spettro: TEM, SHV, oxacillinasi, beta-lattamasi recenti a spettro allargato), classe IV (beta-lattamine cromosomiche a largo spettro), classe V (penicillinasi plasmidiche), classe VI (cefalosporinasi cromosomiche dei Bacteroides), così come le penicillinasi stafilococciche. Per contro, essi non inibi-scono le beta-lattamasi cromosomiche costitutive inducibili di classe I di Enterobatteri, Citrobacter, Serratia, Pseudo-monas. Lo spettro antibatterico degli inibitori (recupero dei ceppi divenuti resistenti alle aminopenicilline, carbos-sipenicilline, ureidopenicilline e, recentemente, anche alle metossi-imino-cefalosporine inattivate dalle beta-latta-masi plasmidiche a spettro allargato comprende: gli stafilococchi meti-S produttori di penicillinasi (80-90% degli stafilococchi), Branhamella catarrhalis (70%), H. influenzae (15%), Neisseria gonorrhoeae secretrici di beta-latta-masi (10%), E. coli, Proteus mirabilis, Klebsiella (10-40%), Campylobacter, Salmonella, Shigella, Yersinia, certi ceppi di Proteus vulgaris, Nocardia e tutti i bacteroidi e fusobatteri produttori di cefalosporinasi. Alcuni inibitori (sulbactam, tazobactam) hanno uno spettro di inibizione più largo, includendo anche certe cefalosporinasi di Proteus vulgaris, Providencia, Morganella. Per questo motivo si è proposto di associarli con le cefalosporine più labili alle beta-lattamasi (cefoperazone). Al contrario, gli inibitori non sono utilizzati in associa-zione con beta-lattamine resistenti all’inattivazione delle beta-lattamasi: penicilline antistafilococciche, carbape-nemi, cefalosporine di 4a generazione, temocillina; ma si possono associare con le cefalosporine di 2a e 3a generazione resistenti alle beta-lattamasi (cefuroxima, cefamicina) e cefalosporina di 3a generazione quando si tratta di beta-lattamasi a spettro allargato (Klebsiella, E. Coli, etc). L’associazione con l’inibitore non è utile per i germi regolarmente sensibili alle beta-lattamine: meningococchi, anaerobi Gram positivi, streptococchi, enterobatteri scarsi produttori di beta-lattamasi rimasti sensibili alle beta-lattamine, Brucella, Bordetella, Pasteurella, Vibrio cholerae, Spirochete, Leptospira, Borrelia, Clostridium, Peptococchi, Peptostreptococchi, Fusobatteri, B. anthracis. In tutti questi germi non si ha variazione della loro sensibilità alle beta-lattamine associando queste ultime con inibitori delle beta-lattamasi. Restano resistenti all’associazione beta-lattamine + inibitore delle beta-lattamasi: stafilococchi meti-R, bacilli Gram negativi iperproduttori di cefalosporinasi di classe I (Enterobacter, Citrobacter, Proteus rettgeri e morganii, Providencia, Serratia, Pseudomonas, Acinetobacter, così come i micobatteri e i germi intracellulari senza parete). I diversi inibitori differiscono tra di loro: -per la capacità di indurre la produzione di beta-lattamasi cromosomiche (cefalosporinasi): a) deboli induttori:
sulbactam, tazobactam; b) forti induttori: clavulanato.
Tuttavia, il rischio di antagonismo per associazione con una beta-lattamina è basso con l’amoxicillina, perchè
non è attiva sui batteri produttori di beta-lattamasi inducibili; è altrettanto basso con l’associazione con la
ticarcillina i virtù del basso rapporto ticarcillina-clavulanato; -per lo spettro di inibizione: il sulbactam, ma soprattutto il tazobactam, hanno uno spettro di inibizione un po’ più
ampio comprendente anche le beta-lattamasi di Providencia e Morganella;
-per la loro fissazione alle PBP: affinità selettiva per la PBP2 (clavulanato, tazobactam) e per la PBP 3 (sulbactam). L’entità della inibizione sulle penicillinasi è nell’ordine: tazobactam = clavulanato < sulbactam. -per la loro attività antibatterica intrinseca: il sulbactam ed il tazobactam hanno un’attività antibatterica propria
su Neisseria, Acinetobacter e Pseudomonas cepacea; l’acido clavulanico agisce su Legionella pneumophila. La resistenza batterica di alcuni germi all’associazione beta-lattamina + inibitore delle beta-lattamasi può essere dovuta a: a) iperproduzione di beta-lattamasi che supera la capacità di inibizione di tali enzimi (infezioni da inoculo molto
abbondante); b) scarsa permeabilità batterica per riduzione od assenza delle porine; c) presenza di beta-lattamasi resistenti agli inibitori (beta-lattamasi TRI); Lo spettro antibatterico proprio degli inibitori delle beta-lattamasi è molto ristretto ed è limitato ai gonococchi e, per sulbactam e tazobactam, all’Acinetobacter.
Farmacocinetica
La farmacocinetica degli inibitori delle beta-lattamasi è molto simile a quella delle beta-lattamine ad essi associate, con qualche lieve differenza: -assorbimento gastroenterico (biodisponibilità orale); esso è buono (75%) per l’acido clavulanico, ma con grandi
variazioni individuali. Il sulbactam viene poco assorbito per via orale (< 10%), ma la sua esterificazione con l’ampicillina (sultampicillina) comporta, dopo idrolisi nella cellula parietale intestinale, lo stesso livello di assorbimento gastroenterico del clavulanato (75-80%, come per l’amoxicillina).
L’emivita è simile (un’ora) per i due inibitori.I picchi sierici sono:-per il clavulanato (125 mg + 500 mg di amoxicillina), di 3-5 µg/ml (di 7-10 µg/ml per l’amoxicillina); dopo 200
mg di clavulanato, 14 µg/ml). -per il sulbactam: 1000 mg ev (+ ampicillina 1000 mg): 30-35 µg/ml; im: 18-25 µg/ml; per os (sultamicillina 750
mg): 8-9 µg/ml per il sulbactam e 6-8 µg/ml per l’ampicillina. -per il tazobactam (500 mg i.v.): 35 µg/ml (perfusione); 18 µg/ml (infusione ev diretta). Il volume di distribuzione è di 0.25 l/Kg per il clavulanato, 0.35 l/Kg per il sulbactam. Scarsa diffusione nel liquor (10%) per il clavulanato e questo è causa di un inadeguato rapporto, a tale livello, tra beta-lattamina/inibitore delle beta-lattamasi. Migliore la diffusione per il sulbactam-tazobactam (1/3 dei tassi sierici). Biotrasformazione metabolica: intensa (40-50%) per il clavulanato; 20% circa per il tazobactam (metaboliti inat-tivi); ridotto per il sulbactam, eliminato sotto forma attiva, non metabolizzato con le urine. Clearance totale (ml/min): 180-220 per il clavulanato, 200-250 per il sulbactam. Clearance renale (ml/min): 90-110 per il clavulanato, più elevata (150-200) per il sulbactam; 200-250 per il tazobactam da solo, ma ridotto a 135 ml/min allorquando viene associato con la piperacillina, per antagonismo con il meccani-smo di secrezione tubulare. Percentuale di escrezione urinaria: 40-50% per il clavulanato (non influenzato dalla somministrazione di probene-cid), 60-75% per il tazobactam. L’escrezione urinaria si realizza per filtrazione glomerulare, per il clavulanato, per filtrazione + secrezione tubulare (bloccata dal probenecid) per il sulbactam e tazobactam. I picchi urinari sono elevati: > 150 µg/ml per il clavulanato, > 300 µg/ml per il sulbactam. Tassi biliari elevati: 15 µg/ml (clavulanato), 20 µg/ml (sulbactam). In caso di insufficienza renale severa l’emivita del clavulanato aumenta relativamente di poco (massimo a 3 ore), mentre quella dell’amoxicillina aumenta fortemente (fino a 18 ore). Per il sulbactam + ampicillina si ha aumento parallelo dell’emivita dei due composti. Eliminazione per dialisi: 40% per il clavulanato, 35-40% per il sulbactam e tazobactam, 25% per l’amoxicillina, 35-40% per l’ampicillina. Nell’insieme, il clavulanato ha una eliminazione metabolica (50%) e renale (50%), il sulbactam ha una eliminazione prevalentemente renale, identica alle penicilline ad esso associate.
Tossicità ed effetti indesiderati
Sono comuni a quelli di altre beta-lattamine. L’acido clavulanico provoca, più frequentemente dell’amoxicillina da sola, dei disturbi gastrici (nausea, vomito), soprattutto quando la frazione di acido clavulanico è alta e si aumentano le dosi. Per attenuarli la somministrazione va ripartita in più dosi, assunte nel corso dei pasti. L’amossicillina-clavulanato a dosi elevate e per trattamenti prolungati può provocare colestasi.
Indicazioni cliniche
1. L’associazione ampicillina + sulbactam è il trattamento di scelta delle infezioni da germi che presentano attual-mente un’alta percentuale di resistenza alle aminopenicilline per secrezione di beta-lattamasi: Haemophilus, Branhamella, stafilococchi, enterobatteri Bacteroides, così come di quelle sostenute da germi secretori di beta-
lattamasi (Klebsiella, E. coli) a spettro allargato (cefotaxime, ceftazidime), resistenti alle cefalosporine di 3a generazione.
-Infezioni delle vie respiratorie superiori: otiti, sinusiti, angina, epiglottite acuta nel bambino; tuttavia quando si tratta di Moraxella catarrhalis, le ricadute sono frequenti alla sospensione del trattamento; l’associazione è particolarmente indicata quando non si riesce ad ottenere la sterilizzazione batteriologica alla fine del tratta-mento per la concomitante presenza di una flora batterica non patogena, ma produttrice di beta-lattamasi e distruttrice delle penicilline labili (patogeni indiretti). Qualche volta è utile (otite da pneumococco a ridotta sensibilità) aumentare la posologia dell’amoxicillina con una dose supplementare.
-Infezioni broncopolmonari: bronchiti croniche riacutizzate, pneumopatie, anche da pneumococco, ma a condizione di aumentare nel composto associato la frazione di amoxicillina.
-Infezioni urinarie recidivanti o complicate (a questo livello, in presenza di concentrazione urinaria elevata, la Klebsiella ed il Proteus divengono sensibili).
-Infezioni genitali alte nella donna (aerobi-anaerobi), eventualmente in associazione con una tetraciclina o un macrolide (Chlamydia).
-Trattamento dell’ulcera venerea molle (H. ducreyi) e della gonococcia.
-Trattamento delle infezioni osteo-articolari.
-Trattamento dei morsi di animali (stafilococchi, anaerobi orali).
-Profilassi e trattamento delle infezioni epatobiliari e dell’ascite infetta nei cirrotici; al contrario, non sono indicati nel trattamento delle infezioni del SNC a causa della scarsa diffusione nel liquor.
-Profilassi nella chirurgia colon-rettale, appendicectomia, chirurgia ginecologica.
L’associazione ampicillina + sulbactam può essere utilizzata, quando effettivamente necessario, anche in corso di
gravidanza o allattamento.
2. Co-ticarciclav (ticarcillina + acido clavulanico) o (piperacillina + tazobactam): spettro allargato rispetto alla ticarcillina o piperacillina che includono gli stafilococchi meti-S, Klebsiella e Bacteroides resistenti alla ticarcillina, Enterobacter, Serratia, Proteus indolo-positivo, produttori di cefalosporinasi.
-Trattamento delle pneumopatie nosocomiali, della mucoviscidosi.-Trattamento delle infezioni setticemiche nei pazienti neutropenici (associato ad un aminoside).-Trattamento delle infezioni urinarie complicate.-Trattamento delle infezioni addominali e pelviche severe.Tuttavia, le resistenze batteriche dovute a meccanismi diversi dalla produzione di beta-lattamasi non sono influenzatedagli inibitori delle beta-lattamasi: è il caso di stafilococchi meti-R, enterococchi, pneumococchi a sensibilità ridotta oresistenti etc. Non si associano, ovviamente, inibitori delle beta-lattamasi con beta-lattamine resistenti alle beta-latta-masi: carbapenemi, latamoxef, cefamicina, cefalosporine di IV generazione.Una indicazione più recente è l’associazione delle cefalosporine di terza generazione con un’inibitore delle beta-lattamasiper il trattamento delle infezioni sostenute da germi produttori di beta-lattamasi a spettro allargato (Klebsiella).
Controindicazioni e precauzioni d’uso
-Controindicazioni: allergia alle beta-lattamine.
-Precauzioni d’uso: tener conto dell’apporto di potassio (clavulanato): 0.5 mEq/100 mg di clavulanato, e dell’apporto di sodio (sulbactam).
Non superare i 200 mg di clavulanato per ogni iniezione e 1200 mg di clavulanato al giorno (ev).
Interazioni farmacologiche
Interazioni utili
-piperacillina+sulbactam: aumento dell’AUC, diminuzione del VD e della clearance del sulbactam ad opera della piperacillina.
Interazioni da evitare
-con il disulfiram (ampicillina + sulbactam).
Forme farmaceutiche
Co-amoxiclav: compresse da 1 g; bustine da 1 g e 312.5 mg; sospensione orale pediatrica; fiale ev da 1200 e 2200 mg. Ampicillina + sulbactam: rapporto 1.2 (via parenterale): ev, im. Fiale ev da 0.56 di sulbactam + 1 g di ampicillina; 250 mg di sulbactam + 0.5 g di ampicillina; fiale ad uso ospedaliero di 2 g di ampicillina + 1 g di sulbactam.
Adulti
La dose totale giornaliera di sulbactam-ampicillina raccomandata per l’adulto varia entro un range di norma compreso tra i 3 ed i 12 grammi e può essere refratta in somministrazioni uguali ogni 12, 8 o 6 ore. La scelta del dosaggio e dello schema di somministrazione dipenderà dalla gravità dell’infezione. In pazienti con grave insufficienza renale (clearance della creatinina < 30 ml/min), il dosaggio di sulbactam-ampicillina dovrà essere monitorato, con somministrazioni meno frequenti, in accordo con ciò che usualmente viene fatto per l’ampicillina.
Bambini
Il dosaggio di sulbactam-ampicillina raccomandato per la maggior parte delle infezioni in età pediatrica e neonata-le è 150 mg/kg/die (corrispondente a 50 mg/kg/die di sulbactam e di 100 mg/kg/die di ampicillina). Nel bambino enel neonato, questa quantità dovrebbe essere somministrata ogni 6 o 8 ore, in accordo con la pratica seguitausualmente per l’ampicillina.Nel neonato, durante la prima settimana di vita (soprattutto nel prematuro) la quantità dovrebbe essere refratta indue dosi uguali, una ogni 12 ore.Sultamicillina tosilato: compresse divisibili da 750 mg (440 mg di ampicillina + 310 mg di sulbactam): 3-4 cpr/die,in due assunzioni quotidiane; sospensione pediatrica.Per la sultamicillina (via orale) può essere necessario un supplemento di ampicillina per via orale per le indicazionisistemiche per la bassa dose di ampicillina data dalla sultamicillina.Co-ticarciclav: rapporto C/T 1/15 e 1/25. Fiale iniettabili da1.2 e 3.2 g.
3.3 CEFALOSPORINE
Generalità
Tra le diverse classi di beta-lattamine, le cefalosporine hanno avuto uno sviluppo spettacolare: esistono attualmen te più di 50 prodotti commerciali adatti alla somministrazione orale o parenterale e la ricerca continua ad identificarne di nuovi sempre più diversificati.
Classificazione
a) Classificazione per “generazioni” di cefalosporine
La classificazione più comune delle cefalosporine, che si è imposta
malgrado le numerose critiche, è quella che sibasa sulle diverse
“generazioni” (prima, seconda, terza e quarta generazione), ognuna delle
quali corrisponde ad uncerto potere intrinseco e spettro antibatterico,
capacità di resistenza all’idrolisi da parte delle beta-lattamasi
bat-teriche, etc.Questa classificazione non tiene conto della data di
scoperta della molecola; per esempio certe cefalosporine oralimolto
recenti (loracarbef, cefprozil), sono classificate per il loro spettro
antibatterico come cefalosporine di primagenerazione.Si possono, quindi,
distinguere:-cefalosporine di prima generazione, a somministrazione
orale o parenterale;-cefalosporine a somministrazione esclusivamente
orale: cefaclor, cefadroxil, cefatrizina, cefradina, loracarbef;
-cefalosporine di prima generazione a somministrazione esclusivamente
parenterale: cefalotina, cefaloridina,
cefapirina, cefacetrile, cefazolina, ceftazolo. Le cefalosporine di prima generazione a somministrazione parenterale si caratterizzano per lo stesso spettro d’azio-ne (si può utilizzare per l’antibiogramma un solo disco con cefalotina che è rappresentativa di tutto il gruppo). Il loro spettro antibatterico include: lo stafilococco e gli altri cocchi Gram positivi (ad esclusione degli enterococchi e degli stafilococchi meti-R), gli enterobatteri non produttori o scarsamente produttori di cefalosporinasi (E. coli, Proteus mirabilis, Salmonella, Shigella), la Klebsiella, la Neisseria e l’Haemophilus non secretore di beta-lattamasi. Lo Pseudomonas e l’Acinetobacter sono resistenti così come gli enterobatteri produttori di beta-lattamasi. Le cefalosporine orali di prima generazione non si distinguono dalle precedenti per spettro d’azione, se non per un’attività nettamente ridotta sugli stafilococchi; tuttavia, alcune cefalosporine recenti (cefaclor) presentano una buona attività anti-stafilococco e sui cocchi Gram positivi. Le cefalosporine di seconda generazione (in particolare le cefamicine), grazie ad una grande stabilità all’idrolisi delle beta-lattamasi, sono caratterizzate da una più elevata attività intrinseca nei confronti degli enterobatteri sensibili alle cefalosporine di prima generazione. Presentano, inoltre, uno spettro d’azione allargato ad alcuni enterobatteri produttori di cefalosporinasi e resistenti alle cafalosporine di prima generazione. Esse sono efficaci nei confronti di cocchi Gram positivi, verso i quali hanno attività equivalente a quella delle cefalosporine di prima generazione, con l’eccezione della cefamicine. Sono, inoltre, attive nei confronti di Neisseria ed Haemophilus secretori di beta-lattamasi resistenti alle cefalosporine di prima generazione. Per le cefamicine, che rientrano per la maggior
parte nel gruppo delle cefalosporine di seconda generazione, lo
spettro antibatterico comprende, in più, glienterobatteri produttori di
beta-lattamasi ad ampio spettro, di derivazione plasmidica
(Klebsiella, E. coli), oltre chegli anaerobi tra cui il
Bacteroides; ma la loro attività sui cocchi Gram positivi, aerobi ed
anaerobi, è inferiore a quelladelle cefalosporine di prima generazione.
Gli Pseudomonas-Acinetobacter sono resistenti.Contrariamente alle
cefalosporine di prima generazione, quelle di seconda generazione
presentano tra loro delleimportanti variazioni per quanto riguarda lo
spettro antibatterico, tanto che è necessario testarle
singolarmentenell’antibiogramma.Le cefalosporine di terza generazione
sono caratterizzate da una grande stabilità alle beta-lattamasi (ad
eccezione,talvolta, delle cefalosporinasi cromosomiche di classe I
iperprodotte e delle beta-lattamasi plasmidiche a spettroallargato di
alcune Klebsiella). Fa eccezione il latamoxef, resistente
all’idrolisi ad opera di queste ultime. Le cefalo-sporine di terza
generazione possiedono uno spettro antibatterico allargato alla
pressoché totalità degli enterobatterie qualche volta agli
Pseudomonas-Acinetobacter. La loro attività antibatterica intrinseca
è molto elevata e si espri-me con una MIC molto bassa, 10-100 volte
inferiore, per certi germi, a quella delle cefalosporine di
generazioneprecedente.Tuttavia, la loro attività antistafilococcica è
inferiore a quella delle cefalosporine di prima generazione, ma la
loroattività antistreptococcica è superiore. Si riscontrano in questa
classe di farmaci anche variazioni importanti ri-guardo soprattutto i
cocchi Gram positivi, gli anaerobi, lo Pseudomonas-Acinetobacter,
al punto che per l’antibio-gramma bisogna testare le singole molecole
separatamente. Solo gli enterobatteri e la
Neisseria-Haemophiluspresentano una sensibilità costante ed omogenea
alle molecole di tutta la classe (per questi germi si può utilizzareper
l’antibiogramma un solo disco contenente cefotaxime).
Le cefalosporine di quarta generazione, più recenti, sono
rappresentate attualmente da molecole che presentano
una sostituzione con ammonio quaternario in C3 ed una
struttura zwitterionica: cefpirome, cefepime, cefclidine,
cefquinone. Esse hanno in comune: un’attività antibatterica
conservata verso mutanti attivati iperproduttori dicefalosporinasi
cromosomiche inducibili di classe I (Enterobacter, Citrobacter,
Serratia, Proteus indologenico, Pseu-domonas) che sono
resistenti alle cefalosporine di terza generazione; una maggiore
permeabilità ed una maggiorepenetrazione attraverso la membrana esterna
dei batteri (grazie alla loro struttura zwitterionica); un’attività
con-servata sullo Pseudomonas almeno pari a quella della ceftazidima
(soprattutto cefclidina) e, per alcune di esse,un’attività
antistafilococcica ed anti enterococcica superiore a quella delle
cefalosporine di terza generazione (at-tività equilibrata tra cocchi
Gram positivi e bacilli Gram negativi). Rimangono resistenti lo
Pseudomonas cepacea,Enterococcus faecium, gli stafilococchi meti-R,
Listeria, Clostridium difficile, anaerobi.Resta qualche cefalosporina
difficile da classificare nell’ambito della seconda e la terza
generazione, per esempiocefotetan, cefotiam, cefpiramide. La loro azione
sugli enterobatteri è leggermente inferiore a quella delle
cefalo-sporine di terza generazione, le prime due generazioni non hanno
alcuna attività sullo Pseudomonas aeruginosa, maesplicano un’azione
sugli anaerobi (cefotetan) o sui cocchi Gram positivi (cefotiam)
superiore alle cefalosporine diterza generazione.Le cefalosporine
contenenti un nucleo catecolico o piridone utilizzano i canali di
trasporto del ferro per penetrareattraverso la parete batterica.
b)Classificazione chimica delle cefalosporine (Figura 3.11)Tutte le
cefalosporine attuali rientrano nelle quattro classi chimiche
seguenti:-cefemi: doppio legame tra C3 e C4 nel
nucleo diidrotiazinico (la grande maggioranza delle cefalosporine);
-cefamicine: + sostituzione alfa-metossi in C7: cefoxitina,
cefotetan, cefmetazolo, cefbuperazone;-oxacefemi: un atomo di O al posto
di un atomo di S nel nucleo diidrotiazinico: latamoxef;-carbacefemi: uno
atomo di C al posto di un atomo di S nel nucleo diidrotiazinico. Per il
momento una sola
cefalosporina, il loracarbef, rientra in questa classe. Nella classe maggiore dei cefemi si ritrovano certe sostituzioni già note per le penicilline: -aminocefalosporine (cefalosporine orali), corrispondenti alle aminopenicilline: radicale alfa-amino in posizione 7; -carbossicefalosporine: latamoxef; -cefalosporine piperazinate: cefoperazone, cefbuperazone (corrispondenti alla piperacillina); -sulfocefalosporine: cefsulodine, corrispondente alle sulfopenicilline (sulbenicillina). Altre categorie chimiche si ritrovano solo tra le cefalosporine: a) Aminotiazol-metossi-imino-cefalosporine, per esempio cefotaxime, che hanno aperto la strada alle cefalospori
ne più attive di terza e quarta generazione:
-A somministrazione parenterale: di terza generazione: ceftazidima, cefotaxime, ceftizoxime, cefmenoxime, ceftriaxone, cefodizime, cefuzonam; di quarta generazione, N quaternario in C: cefpirome, cefepime, cefclidina, cefquinome.
COMPOSTO D’ORIGINE: ACIDO CEFALOSPORANICO
H
![]() S
S
 N
CH CH
N
CH CH

B A
H
![]() A=
Anello diiIdrotiazinico
A=
Anello diiIdrotiazinico
N
![]() CH-OCOCHB=
Anello β -lattamico
CH-OCOCHB=
Anello β -lattamico
O
23
COOH FORMULA GENERALE: CEFEMI OXACEFEMI (OXACEFALOSPORINE)
 S
S
 O
O
R1 CONH 7 Diidro-RCO NHtiazinico 1 Diidro-N oxazinico
O
3 RHN COOH2 O
R2
COONa CEFAMICINE CARBACEFEMI
H
2
R1CO
 NH
S R1
NH
S R1
![]() C
X
C
X
N NR2 O
RO
2
COOH COOH
Figura 3.11 Struttura base delle cefalosporine.
-A somministrazione orale: di terza generazione: cefetamet pivoxil, cefteram pivoxil, cefpodoxime proxetil, cefditoren
pivoxil, cefixime; b) Ossi-sostituite con l’acido carbossilico: carbossi-propil-oxi-imine: ceftazidima. A seconda della loro indicazione particolare per certi agenti batterici si possono distinguere: -cefalosporine antistafilococciche: cefalosporine di prima generazione; -cefalosporine anti-Pseudomonas: ceftazidima, cefsulodina, cefoperazone, cefpimizole, cefpiramide, cefpirone,
cefepime, cefclidina; -cefalosporine anti-anaerobi: cefamicina, latamoxef, flomoxef. c) In base al loro spettro d’azione antibatterico si distinguono: -cefalosporine a spettro ristretto: cefsulodina; -cefalosporine a spettro medio: cefalosporine di prima e seconda generazione; -cefalosporine a spettro largo o molto largo: cefalosporine di terza e quarta generazione. d) In base alla loro farmacocinetica le cefalosporine si possono classificare: -a seconda del loro assorbimento o non assorbimento per la via gastroenterica (cefalosporine orali o parenterali); -a seconda della loro emivita plasmatica: breve (< 1 ora), media (≤ 2 ore) lunga (≥ 4 ore) (vedi farmacocinetica); -a seconda della modalità di eliminazione: renale (la maggior parte). A doppia via di eliminazione (epatica e
renale) o a predominanza epatica (cefoperazone, cefbuperazone, cefixime, ceftriaxone, cefpiramide).
Composizione chimica ed origine (Figura 3.12) Lo sviluppo delle cefalosporine è cominciato con l’isolamento da parte di Brotzu, in Sardegna, nel 1945, di un ceppo di Cephalosporium acremonium (Acremonium chrysogenum) che secerneva un materiale attivo sui batteri Gram positivi e Gram negativi. Questo materiale inviato successivamente a Londra per sottoporlo all’attenzione dell’equipe del prof. Florey, portò all’isolamento della cefalosporina C rivelatasi resistente alle beta-lattamasi stafilococciche. Successivamente si è isolato, per idrolisi della cefalosporina C, l’acido 7-aminocefalosporanico (7-ACA) che, come il suo omologo per le penicillina, l’acido 6-aminopenicillanico (6-APA), è stato il punto di partenza per tutte le cefa-losporine semisintetiche attuali. Esse si ottengono per semisintesi a partire sia dall’acido 7-aminopenicillanico sia dalla cefalosporina C in più fasi successive: ottenimento della cefalosporina C da colture sia di un Cephalosporum (fungo) (per la grande maggio-ranza delle cefalosporine) sia di Streptomyces (batterio filamentoso) (cefamicine); successivamente si passa alla sintesi, a partire da questi composti, del nucleo 7-ACA e quindi all’acetilazione che permette le sostituzioni in C7 ed in C.
3
Tutte le sostituzioni sul nucleo di base delle cefalosporine si possono ottenere su quattro punti della molecola: -su C7 beta (legame amidico), responsabile dell’attività antibatterica e della resistenza alle beta-lattamasi (oxiimine); -su C3, responsabile soprattutto della farmacocinetica della cefalosporina, ma qualche volta anche dell’attività antibatterica (esempio cefaclor, cefuzonam);
-sostituzione 7-alfa-metossi, sul nucleo beta-lattamico, responsabile soprattutto della resistenza all’idrolisi ad opera delle beta-lattamasi e dell’attività sugli anaerobi: cefamicine, sostituite con un atomo di ossigeno (oxacefemi), acido clavulanico, o con un atomo di carbonio (carbapenemi, più stabili e più resistenti all’idrolisi da parte delle beta-lattamasi).
Tutte le sostituzioni esercitano influenze diverse e qualche volta contraddittorie: ad esempio la sostituzione 7alfa-metossi aumenta la resistenza all’idrolisi ad opera delle beta-lattamasi, ma allo stesso tempo riduce l’attività anti-batterica sui cocchi Gram positivi, etc. Tutti gli sforzi attuali sono diretti ad ottenere delle cefalosporine che abbiano una buona attività sui cocchi Gram positivi, gli enterobatteri, lo Pseudomonas, l’Acinetobacter, gli anaerobi.
Proprietà fisico-chimiche
Polvere bianca cristallina, idrofila, peso molecolare medio,
circa 400. Alcune cefalosporine devono essere conserva-te in
frigorifero (4° C). Funzione acida su C4, la cui
esterificazione aumenta la lipofilia e l’assorbimento per
viadigestiva. Contrariamente ad alcune penicilline, le cefalosporine
sono stabili in ambiente acido, anche se possononon essere
assorbite.Per le cefalosporine a somministrazione parenterale si
utilizzano i relativi sali per solubilizzarle: sodico,
disodico,cloroidrato (cefotiam, cefmenoxime) e qualche volta si
aggiunge del carbonato di sodio (cefamandolo, cefradine,ceftazidima,
cefotiam, cefmenoxime). Il pH della soluzione varia molto da un
prodotto all’altro (da 3 a10). Per ilcefamandolo si utilizza, al
fine di aumentare la sua stabilità, l’estere formico (nafato) del
sale sodico.Per le cefalosporine orali si sfrutta soprattutto il
legame con un radicale lipofilo e si utilizza sia la forma
libera(acida) delle aminocefalosporine che degli esteri a livello
del gruppo carbossilico in C4, formando così dei pro
farmaci: cefuroxima axetil, cefotiam exetile, cefcanel daloxato,
cefpodoxime proexetile, cefteram pivoxil, cefetamet
pivoxil.
La maggior parte delle cefalosporine sono dei monoacidi
(monoanioniche): cefacetrile, cefazolina, cefoxitina,
cefamandolo, cefotaxime, cefuroxime, ceftizoxime, cefoperazone.
Alcune cefalosporine sono dianioniche (diacidi): latamoxef,
ceftriaxone, altre sono zwitterioni: cefalexina, cefaclor,
cefaloridina, oppure portatrici di due cariche negative e di una
carica positiva: cefsulodina.
torna su vai all'Home Page vai all'indice antibioticoterapia
Meccanismo d’azione
Azione battericida per inibizione della sintesi del peptidoglicano della parete batterica dovuta all’inibizione irrever-sibile delle transpeptidasi, localizzate sulle PLP, nella fase finale della sintesi delle mureine parietali. La maggior parte delle cefalosporine hanno un’affinità selettiva per le PBP 3 e, a volte, se la concentrazione aumenta, per le PLP 1a e 1b. Alcune cefalosporine come cefaloridina, cefsulodina, cefoxitina, hanno un’affinità preferenziale per le PBP 1a e 1b, ma a concentrazioni aumentate possono legarsi anche alle PBP 3. Alla loro azione contribuisce anche la capacità di diffusione attraverso i pori della parete batterica (cripticità) che è variabile da una cefalosporina all’altra e che è importante soprattutto per gli enterobatteri e lo Pseudomonas. -La loro stabilità all’azione delle beta-lattamasi, che è massima per le cefamicine e le cefalosporine di terza e
quarta generazione; -La loro capacità di induzione delle beta-lattamasi (Tabella 3.1).
Spettro d’azione e resistenze batteriche
1) Cefalosporine di prima generazione a somministrazione parenterale (Tabella 3.14)Lo spettro comune a tutte le cefalosporine di prima generazione include:-cocchi Gram positivi: ottima attività (MIC < 0.3 µg/ml) sugli stafilococchi (che compete con le penicilline antista-
filococciche), ad eccezione che sugli stafilococchi meti-R. La cefalotina è in questa generazione la più resistente (stabile) all’idrolisi ad opera delle penicillinasi stafilococciche. Sono parimenti molto sensibili gli streptococchipneumococchi (ma meno sensibili che alla penicillina G ed alle cefalosporine di terza generazione). Gli enterococchi sono resistenti, come del resto lo sono verso le cefalosporine delle generazioni successive.
-I bacilli Gram positivi: B. diphterico, Erisipelotrix.
-I cocchi Gram negativi: Neisseria, ad eccezione dei germi secretori di beta-lattamasi.
-Alcuni enterobatteri non secretori di cefalosporinasi, sensibili parimenti alle aminopenicilline: E. coli, Proteus mirabilis, Salmonella, Shigella, MIC 2-8 µg/ml, così come Klebsiella, secretore di beta-lattamasi di classe IV (MIC 4-32 µg/ml), insensibile alle aminopenicilline.
-L’Haemophilus e la Branhamella, non secretori di beta-lattamasi (tranne che per il loracarbef).
-Alcuni anaerobi: sono molto sensibili: fusobatteri (MIC < 0.5 µg/ml), Clostridium perfrigens, peptococco e peptostreptococchi anaerobi (MIC < 1 µg/ml), più attive che le cefalosporine di seconda e terza generazione; per contro il Clostridium difficile ed i Bacteroidi sono resistenti.
-Treponema
-Germi resistenti (MIC ≥ 32 µg/ml): stafilococchi meti-R, Enterococchi, Nocardia, Listeria, bacilli Gram negativi produttori di cefalosporinasi: Proteus indolo-positivo, Providencia, Enterobacter, Citrobacter, Serratia, Pseudo-monas, Acinetobacter, Yersinia, Campilobacter, Clostridium difficile o Bacteroides, Chlamydia, Mycoplasma, Le-gionella.
-Resistenza crociata con le penicilline antistafilococciche.
2) Cefalosporine di prima generazione a somministrazione orale
Posseggono più o meno lo stesso spettro d’azione, salvo che le cefalosporine orali “classiche” che hanno un’attività ridotta sullo stafilococco aureo, ad eccezione del cefaclor. Sull’Haemophilus la loro attività è insufficiente, ad eccezione del cefaclor e del loracarbef.
3) Cefalosporine di seconda generazione a somministrazione parenterale (Tabelle 3.14 e 3.15)
Non presentano uno spettro d’azione omogeneo come le cefalosporine di prima generazione (cef1), ma vi sono delle
differenze importanti in rapporto ai diversi germi (è necessario testarle separatamente nell’antibiogramma). Come
regola generale, lo spettro d’azione del cefonicid è sovrapponibile a quello del cefamandolo, del ceforanide e della
In rapporto alle cef1 esse presentano uno spettro più ampio, dovuto alla loro maggiore stabilità alle beta-lattamasi
degli enterobatteri, di Neisseria-Haemophilus- Branhamella e ad un potere antibatterico intrinseco maggiore sugli
enterobatteri (MIC più basse). Per gli stafilococchi esse conservano la buona attività delle cef1, ad eccezione delle
cefamicine, meno attive.
Il loro spettro antibatterico comune include:
-Neisseria, Haemophilus e Branhamella Moraxella secretori di beta-lammasi e resistenti alle cef1
-Enterobatteri sensibili alle cef1 (E. coli, Proteus mirabilis, Salmonella, Shigella, Klebsiella), ma con MIC più basse (1-2 mg/ml).
-Treponema, Leptospira, Pasteurella multocida.
L’attività è diversa per altri germi:
-I Bacteroidi sono sensibili alle cefamicine, ma resistenti al cefamandolo ed al cefuroxime.
-Clostridium perfrigens è sensibile al cefamandolo e poco sensibile alla cefuroxima. I cocchi anaerobi sono, per contro, molto sensibili al cefuroxime e alle cefamicine, moderatamente sensibili al cefamandolo. Il Fusobacterium è molto sensibile al cefuroxime, al cefamandolo ed al cefotetan, poco sensibile o resistente alla cefoxitina.
-La sensibilità del Proteus indolo positivo, del Citrobacter varia spesso con le differenti cefalosporine di seconda generazione (il Proteus vulgaris è resistente al cefamandolo ed alla cefuroxima). L’Enterobacter è praticamente resistente alle cefalosporine di seconda generazione.
-Lo staphilococcus aureus è molto sensibile alla cefuroxima ed al cefamandolo, molto meno alle cefamicine. Gli streptococchi ed gli pneumococchi sono molto sensibili alla cefuroxima ed al cefamandolo. Gli streptococcus viridans sono poco sensibili alla cefoxitina.
-Germi resistenti: enterobatteri grandi produttori di cefalosporinasi, Pseudomonas-Acinetobacter, Staphilococcus meti-R, Enterococchi, Campylobacter, Nocardia, Listeria, Chlamydia, Mycoplasma, Legionella, Clostridium diffici-le, Rickettsia.
Il cefamandolo presenta un effetto inoculo più importante che le altre cef2. Il cefamandolo e la cefoxitina hanno un
effetto induttore importante sulle beta-lattamasi.
Le cefalosporine “di transizione” tra le cef2 e le cef3 (cefotetan, cefotiam, cefpiramide, cefbuperazone) presentano
le stesse variabilità di spettro antibatterico:
-il cefotiam, il cefotetan e il cefbuperazone hanno una un’attività molto buona sugli enterobatteri, con una MIC che si avvicina a quella delle cef3, ma non posseggono alcuna attività su Pseudomonas. Al contrario, la cefpiramide possiede un’attività media sugli enterobatteri, ma una buona attività anti-Pseudomonas e sui cocchi Gram posi-tivi. Il cefotetan si distingue per un’attività in più su tutti gli anaerobi, attività leggermente inferiore a quella della cefoxitina, ed il cefotiam per una buona attività sui cocchi Gram positivi, superiore a quella delle cef3.
La Klebsiella produttrice di beta-lattamasi resta sensibile alle cefamicine, al latamoxef ed all’ imipenem (non idrolizzati dalle beta-lattamasi).
4) Cefalosporine orali di seconda generazione
(cefuroxime axetil, cefotiam exetile)
Presentano lo stesso spettro d’azione delle cef2 da cui esse
derivano per esterificazione su C3.
5) Cefalosporine di terza generazione a somministrazione
parenterale (Tabella 3.16)Il loro spettro antibatterico è più ampio
grazie alla loro stabilità alle beta-lattamasi batteriche
plasmidiche (adeccezione delle beta-lattamasi plasmidiche a spettro
allargato) e ad un’attività intrinseca molto più potente, condelle
MIC per gli enterobatteri 20-100 volte più basse (inferiori a 1
µg/ml), rispetto alle cef1 ed alle cef2. Per questoesse presentano
un ottimo quoziente di inibizione. La loro attività è relativamente
omogenea sui germi moltosensibili: enterobatteri, Neisseria,
Haemophilus, Branhamella, Streptococco A, pneumococco,
Pasteurella, Treponema,Borrelia. Per contro,
essa varia da un prodotto all’altro per gli altri cocchi Gram
positivi (stafilococchi), lo Pseudo-monas-Acinetobacter, gli
anaerobi. Sugli stafilococchi la loro attività è globalmente
inferiore a quella delle cef1 ecef2, ma la loro attività
antistreptococcica è superiore a quella della cef1. Sugli
pneumococchi alcune cef3 esplica-no una buona attività (MIC < 0.25
µg/ml): cefotaxime, ceftazidima, cefuzonam, ceftizoxime,
cefmenoxime, ceftriaxone,
cefepime, cefpirome; altre (latamoxef) hanno un’attività mediocre.
Sugli pneumococchi a sensibilità intermedia o
resistenti alla penicillina G, il cefotaxime, il cefpirome ed
il ceftriaxone sono i più attivi.
Per gli stafilococchi meti-S, l’attività è buona per il
cefuzonam, ceftazidima, cefoperazone, cefotaxime, è mediocre
per latamoxef e ceftriaxone. Si può dire che le cefalosporine
anti-Pseudomonas e anti-anaerobi hanno in generaleuna scarsa
attività anti-stafilococcica. Come per le cef1 e le cef2, gli
stafilococchi meti-R, gli pneumococchipenicillino-resistenti e gli
enterococchi sono resistenti anche alle cef3. Il flomoxef ed
il cefuzonam sono le sole cef3che esplicano una certa attività sugli
stafilococchi meti-R. Il latamoxef è inattivo sugli streptococchi di
gruppo B.Gli enterobatteri sono estremamente sensibili a tutte le
cef3 (MIC < 0,2 µg/ml), così come la Pasteurella.
Ilcefoperazone è più labile alle beta-lattamasi plasmidiche di certi
germi (Klebsiella, Providencia, Serratia,
Citrobacter,Enterobacter) con MIC più variabili (0.25-64
µg/ml).Tuttavia, l’associazione con un inibitore delle
beta-lattamasi rende sensibile la Klebsiella produttrice di
beta-latta-masi a largo spettro.Sullo Pseudomonas aeruginosa,
solo qualche cefalosporina di terza generazione ha un’attività
sufficiente per poteressere utilizzata in clinica e, cioè, in ordine
decrescente, ceftazidima, cefsulodina, cefpirone, cefepime,
cefoperazone,cefpimizolo, cefpiramide (MIC 1-4 µg/ml). Gli altri
Pseudomonas (Maltophilia, cepacia, flavobacterium, etc.)
sonomeno sensibili o resistenti. Un’eccezione è la sensibilità dello
Pseudomonas cepacia e Pseudomallei a cefotaxime
eceftazidima e dello Pseudomonas (xanthomonas) maltophila al
latamoxef. Altre cef3: cefotaxime, ceftriaxone, han-no una certa
attività anti-Pseudomonas, ma insufficiente per poterla
sfruttare sul piano clinico. Il latamoxef ècompletamente privo di
attività anti-Pseudomonas (resistenza naturale).Su
Acinetobacter solo la ceftazidima ed il cefpirone presentano una
certa attività (inferiore all’imipenem). Sugli altribatteri
responsabili di infezioni nosocomiali: Citrobacter, Enterobacter,
Serratia, Klebsiella, posseggono una buonaattività, ad eccezione
che sui ceppi produttori di beta-lattamasi a largo spettro e sui
mutanti attivati. Questa attivitàintrinseca importante sul gruppo
KES (Klebsiella, Enterobacter, Serratia) iperproduttori di
beta-lattamasi a largo spet-tro o di cefalosporinasi distingue
essenzialmente le cef3 dalle cef1 e cef2. Sull’Haemophilus,
Branhamella catarrhalise Neisseria (gonorrhoeae
e meningitidis), tutte le cef3 sono essenzialmente attive
(con MIC estremamente basse,dell’ordine di 0.003-0.05 µg/ml), anche
su ceppi secretori di beta-lattamasi.Sugli anaerobi (Bacteroides),
solo il latamoxef, le cefamicine e la ceftizoxime hanno un’attività
(tuttavia inferiore alleureidopenicilline). Gli altri anaerobi sono
variamente sensibili: molto sensibili sono Fusobacterium (ad
eccezione che alceftizoxime, cefoperazone, latamoxef, poco attivi o
del tutto inattivi) e cocchi Gram positivi anaerobi (MIC 0,25-8
µg/ml); Clostridium perfrigens è moderatamente sensibile (MIC
2-16 mcg/ml), meno che alle cef1. Gli anaerobi Grampositivi non
sporigeni: Propionibacterium, Eubacterium, Actinomyces, sono
molto sensibili alle cef3.Germi resistenti: streptococco fecale,
stafilococco meti-R, Listeria, Nocardia, Corynebacterium J.K. e D2,
Rhodococcusequi, Clostridium difficile, Legionella, Campylobacter,
Chlamydia, Mycoplasma, Rickettsia, Pseudomonas
maltophila,flavobacterium meningosepticum, alcaligeni. Lo
Pseudomonas aeruginosa presenta una percentuale di resistenza
dicirca il 30% dovuta all’iperproduzione di cefalosporinasi di
classe 1. Recentemente una percentuale di Enterobacter(30%
circa), Citrobacter, Proteus indologenico, Serratia, grandi
produttori di cefalosporinasi cromosomiche di classe I,mutanti
iperinducibili attivati stabili sono diventati resistenti alle cef3,
come la Klebsiella secernente beta-lattama-si a largo spettro
(10%). Solo il latamoxef, l’imipenem e le cefamicine restano attive
sui germi produttori di beta-lattamasi a largo spettro. Per i germi
molto sensibili: Haemophilus, Neisseria, Moraxella, Salmonella,
Shigella, Pro-teus mirabilis, si può utilizzare per
l’antibiogramma il cefotaxime rappresentativo di tutte le cef3. Per
tutti gli altrigermi, bisogna testare individualmente le diverse
cef3.
CEFALOSPORINE DI 1a GENERAZIONE (PARENTERALI) R CONH
O
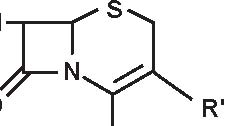
COOH
R R'
![]() CH2
OCOCH3 CEFALOTINA
CH2
OCOCH3 CEFALOTINA
S CH2
NN N CH2 CH2 S
R COOH R'
![]() LATAMOXEF
LATAMOXEF
HO
CH S
N
COOH
CH3
Figura 3.12 Struttura chimica delle cefalosporine.
CEFAMICINE DI 2a GENERAZIONE (PARENTERALI) OCH3
COOH R R'
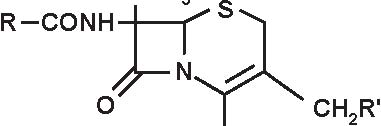
![]() CH2
OCONH2 CEFOXITINA
CH2
OCONH2 CEFOXITINA
S
N CCH2SCH2 S
 N
CEFMETAZOLO
N
CEFMETAZOLO
CH3
O
![]() S
S
 CEFOTETAN
N CH3
CEFOTETAN
N CH3
CEFALOSPORINE ORALI ESTERIFICATE DI 3a GENERAZIONE
 N
N
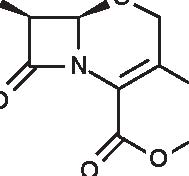 S
S
R1
ON O R2
R3
CH3 O
 O
O
![]() O
O
![]() CH3
CEFPODOXIMA R1=
CH3
CEFPODOXIMA R1=
R2=CH2OCH3 R3= CH3 O CH3
CH3
H2N CH3 CH3
 R3=
R3=
 O
CEFETAMET R1= R2=CH3
O
CEFETAMET R1= R2=CH3
![]() CH3
CH3
O
H2N
Figura 3.12 (Continua).
CEFALOSPORINE DI 3a GENERAZIONE (PARENTERALI)
COOH
R R'
OH
![]() CH
CH
 O
O CH2S CEFOPERAZONE
O
O CH2S CEFOPERAZONE
NHCO
![]() N
N
C2H3 CH3
NOCH3 C CH2OCOCH3 CEFOTAXIMA
NOCH3 C H CEFTIZOXIMA
NOCH3 CH 3
NH2
3
NH2
![]() N
C CH2S OH CEFTRIAXONE S
N
C CH2S OH CEFTRIAXONE S
CH3
N O C COOH
CEFTAZIDIMA NH2
![]() N
CH3 CH2C
N
CH3 CH2C
S C
 CH3
CEFODIZIME
CH3
CEFODIZIME
NH![]() 2S
N
2S
N
![]() CH2S
CH2CO2H OCH3
CH2S
CH2CO2H OCH3
Figura 3.12 (Continuazione).
CEFALOSPORINE ORALI NON ESTERIFICATE
R CONH
O COOH R R'
CH CH3 CEFALEXINA NH2
![]() CH
CH3 CEFRADINA NH2
CH
CH3 CEFRADINA NH2
HO CH CH3 CEFRADROXIL NH2
HO
![]() CH
CH2S
CH
CH2S
![]() CEFATRIZINA
CEFATRIZINA
N
NH2
H
CH CI CEFACLOR NH2
CEFIXIMA (3a GENERAZIONE) S
C CONH N
H2N![]() S
N O
S
N O
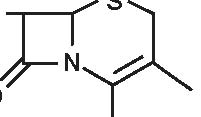 CH=CH3
CH=CH3
OCH2COOH COOH
STRUTTURA IN COMUNE DELLE CEFALOSPORINE DI 4a GENERAZIONE OH
H
CN
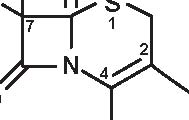 HS
HS
R1
![]() 71
2
71
2
N4
O R2
COO-
Figura 3.12
6) Cefalosporine orali di terza generazione
Possono essere classificate in due categorie:-cef3 orali non
esterificate: cefixime, ceftibuten, cefdinir, cefprozil;-cef3 orali
esterificate in C3 (profarmaci): cefetamet pivoxil,
cefteram pivoxil, cefpodoxime proxetil, cefotiam
exetile, cefadaloxime pentexil, cefditoren pivoxil. Il loro spettro d’azione antibatterico è variabile (Tabella 3.17): -sugli stafilococchi meti-S l’attività è nulla per il ceftibuten, cefetamet e cefixime, mediocre per cefteram,
cefpodoxime; buona per il cefdinir, cefditoren. -sugli streptococchi-pneumococchi, sensibili alle penicilline, tutte le cef3 hanno una buona attività, ma con pos-sibile resistenza per Streptococcus bovis e viridans. -sugli enterobatteri tutte le cef3 hanno una ottima attività, ad eccezione di M. morgagni, resistente al cefetamet, poco sensibile al cefixime e cefpodoxime, sensibile al ceftibuten e al cefteram. -molto buona l’attività di tutte le cefalosporine orali di terza generazione su Branhamella catarrhalis ed H. In-
fluenzae, produttori o non di beta-lattamasi, su Neisseria, Propionibacterium, Pasteurella, Salmonella, Shigella. Germi resistenti a tutte le cef3 orali: Pseudomonas aeruginosa, Acinetobacter, stafilococchi meti-R, enterococchi, Listeria, Corynebacterium, Clostridium difficile, Staphilococcus saprophiticus, Flavobacterium menigosepticum, Chlamidya, Mycoplasma, Rickettsia, Bacteroides ed anaerobi in genere.
7) Cefalosporine a spettro ristretto: cefsulodine
Spetto antibatterico: Pseudomonas aeruginosa, e in misura minore, Neisseria e cocchi Gram positivi, ad eccezione degli enterococchi.
Farmacocinetica
I differenti parametri farmacocinetici delle cef3 sono molto variabili, soprattutto per quanto riguarda la emivita plasmatica, il legame con le proteine plasmatiche, la biotrasformazione metabolica e le vie di eliminazione (renale
o epatica) (Tabelle 3.18, 3.19, 3.20, 3.21).
1) Assorbimento gastroenterico (biodisponibilità)
Per le cefalosporine orali, la biodisponibilità è la
seguente:-molto buona (circa 90%) per la cefalexina, cefradina,
cefaclor, cefroxadina, cefadroxil, cefprozil, ma per le prime
tre è ritardata dalla presenza di alimenti; -buona (50-60%) per la cefatrizina; -buona, ma aumentata con la somministrazione di un pasto per alcune cefalosporine orali di seconda e terza
generazione: cefalosporine esterificate: cefuroxime axetil, cefpodoxime proxetile, cefteram pivoxil, cefetamet pivoxil: 40% a digiuno, 50-60% dopo un pasto; -media (40-50%) per la cefixima, cefdiam, non influenzata dai pasti.
2) Picchi sierici
Dopo somministrazione im di 1 g, i picchi sierici variano tra 18 e 95 µg/ml; i picchi più alti sono garantiti dallecefalosporine fortemente legate alle proteine plasmatiche: cefazolina, cefoperazone, ceftriaxone , cefotetan, cefonicid.Dopo somministrazione iv di 1 g i picchi sierici variano tra 100 e 150 µg/ml e possono raggiungere i 200 µg/ml conle cefalosporine che si legano fortemente con le proteine plasmatiche (cefonicid, cefoperazone).Per le cefalosporine di prima generazione i picchi sierici sono più bassi: 40-70 µg/ml per la cefalotina, la cefaloridina,la cefalexina iv, il cefacetrile, la cefapirina, ad eccezione della cefazolina (picco 80-140 µg/ml).Tra le cef3, solo il flomoxef dà picchi sierici più bassi (45 µg/ml dopo 1 g iv).Le cefalosporine orali di prima generazione danno tassi sierici di 12-18 µg/ml, solo la cefadrizina dà dei picchisierici più bassi (5-7 µg/ml). Le cef3 orali danno tassi sierici più bassi di 3-10 µg/ml.
3) Emivita plasmatica
È breve (< 1,3 h) per la maggior parte delle cefalosporine di prima e seconda generazione: cefalotina (0.5 h), cefapirina (0.6 h), cefacetrile (0.7 h), cefradina (0.8 h), cefoxitina (0.8 h), cefaclor (0.8 h), cefalexina (1 h), cefroxadina (1 h), loracarbef (0.8 h), cefadroxil e cefprozil (1.3 h), cefamandolo (0.8 h), cefuroxime (1.2 h), cefotiam (1 h), cefmetazolo (1 h) e tra le cefalosporine di terza generazione, flomoxef (0.8 h), cefotaxime (1 h), ma il suo metabolita deacetilato ha un’emivita più lunga (1.6 h), cefmenoxime. L’emivita è media (1.5-3 h) per la cefaloridina (1.5 h), la cefaloxina (1.8 h), la cefatrizina (1.5 -2 h), cefbuperazone (1.6 h), cefoperazone (2 h), ceftizoxime (1.8 h), ceftadizima (1.8 h), cefetamet (2 h), ceftibuten (1.7-2 h), cefsulodine (2 h), latamoxef (2.5 h), ceforanide (3 h). L’emivita è lunga (3.5-5 h) per il cefonicid (4.5 h), cefpiramide (5 h), cefotetan (2.5-4 h), cefixime (3.5 h), cefodizime (4 h). L’emivita è molto lunga (> 7 h) per il ceftriaxone. L’emivita plasmatica si allunga in caso di insufficienza epatica per le cefalosporine caratterizzate da un’eliminazione epato-biliare im portante (ceftriaxone , cefpiramide, cefoperazone, cefotetan) ed aumenta in caso di insufficienza renale per tutte le altre cefalosporine, ma soprattutto per la ceftizoxima, ceftazidima, cefotetan, latamoxef, cefsulodina. Per il cefotaxime l’insufficienza renale aumenta di poco la sua emivita, soprattutto del suo metabolita deacetilato. Le cefalosporine con emivita breve hanno in generale uno scarso legame con le proteine plasmatiche e sono molto attivamente secrete dai tubuli renali, mentre le cefalosporine ad emivita più lunga posseggono, di solito, un legame con le proteine plasmatiche molto alto ed un’eliminazione renale solo per filtrazione glomerulare, senza secrezione tubu-lare. L’assenza di secrezione tubulare e l’aumento del legame alle proteine aumenta l’emivita delle cefalosporine.
4) Legame con le proteine plasmatiche
(15-25%), cefadroxil (15%), cefacetrile (20- 30%), cefroxadina (10%), cefradina (10%), cefetamet (22%),
cefsulodina (15-20%), cefuroxima (30-35%), cefpodoxima (30%), cefepime (18%). - È medio (40-70%) per la cefotaxima (40%), latamoxef (50%), cefatrizina (55-60%), cefapirina (45%), cefmenoxima
(60%), cefotiam (40%), cefoxitine (65-70%), cefalotina (65%), ceftibuten (63%), cefixima (67%), cefepima (45%). -È elevato (> 75%) per il ceftriaxone: 90-95% e la cefodizima 80-90% (il legame per queste due cefalosporine è
saturabile e dose dipendente cioè esso diminuisce con dosi più elevate), cefoperazone (90%), cefpiramide (95%),
cefazolina (85%), cefotetan (90%), cefmenoxima (75%), cefamandolo (75%), ceforanide (85%), cefonicid (95%),
cefmetazolo (85%), cefodizime (80-90%), cefuzonam (93%).
5) Biotrasformazione metabolica
Si verifica a livello della sostituzione dell’estere acetico su C3 (cefalosporine acetilate: cefalotina, cefapirina, cefacetrile, cefotaxime), per idrolisi dell’estere ad opera delle idrolasi. Per il ceftibuten si verifica la conversione dal ceftibuten cis nel suo metabolita trans. Per le altre cefalosporine la biotrasformazione metabolica è molto scarsa (<10%) e sono eliminate immodificate e batteriologicamente attive per via urinaria o biliare. I metaboliti desacetilati delle cef1 perdono la loro attività antibatterica, ma il metabolita desacetilato del cefotaxime possiede un’attività anti-batterica solo di poco inferiore al prodotto non metabolizzato (attività equivalente a quella della cefuroxima), è più stabile all’idrolisi di certe beta-lattamasi e soprattutto presenta su molti germi un’attività sinergica con il prodotto di origine, che è più evidente in caso di insufficienza renale allorquando l’emivita del metabolita si allunga molto più di quella della cefotaxima, prolungando di fatto l’attività antibatterica di quest’ultima. L’insufficienza epatica è responsabile di un effetto contrario e cioè essa riduce la formazione del metabolita desacetilato. La notevole biotra-sformazione metabolica della cefotaxima (circa il 30% viene eliminato con le urine sotto forma di desacetil cefotaxima) fà si che la sua emivita aumenti solo di poco in caso di insufficienza renale.
6) Concentrazione ed eliminazione biliare
L’eliminazione epatobiliare costituisce la via principale di eliminazione del cefoperazone: 60-80% (la restante parte è eliminata per via renale); cefixima (80%), cefpiramide (70-80%), cefbuperazone. Tale via di eliminazione è impor-tante per il ceftriaxone (40%), il cefotetan (10-20%), la cefodizima (10%). In virtù di questo fatto, in caso di insufficienza renale la posologia giornaliera delle cefalosporine può, spesso, non essere ridotta. Le due vie di elimi-nazione, renale e biliare, possono reciprocamente “sostituirsi” in caso di insufficienza renale o biliare (aumento della eliminazione attraverso la via intatta): aumento dell’escrezione biliare in caso di insufficienza renale, aumento di eliminazione renale in caso di insufficienza epatica. I tassi biliari saranno quindi elevati col cefoperazone, cefixima, cefpiramide, cefbuperazone, ceftriaxone, cefotetan, e restano molto importanti (nettamente superiore ai tassi sierici) con latamoxef, flomoxef, cefixima e cefamandolo. Per contro, i tassi biliari sono inferiori a quelli sierici con cefaloridina, ceftizoxima, ceftazidima, cefsulodina. Le cefalosporine a somministrazione parenterale (quindi non assorbite per via orale) non presentano un circolo entero-epatico, anche se una percentuale importante è eliminata per via biliare. Un’eliminazione biliare molto importante può favorire l’insorgenza di disturbi digestivi (diarrea, colite acuta o pseudomembranosa e la colonizzazione batterica del tubo digerente).
7) Diffusione e volume di distribuzione (V. D.)
Il volume di distribuzione delle cefalosporine corrisponde a quello dei liquidi extracellulari (circa 15 litri); per le cefalosporine ad alto legame alle proteine plasmatiche (cefotetan, ceftriaxone, cefonicid, cefbuperazone) il V.D. è ridotto (10-12 litri), ma questo è compensato dal fatto che il V.D. della frazione libera, non legata, è molto alto. Alcune cefalosporine hanno un V.D. più alto, pari o maggiore a 25 l: cefapirina (30 l), cefotiam (32 l), cefmenoxima (25 l), cefodizima, cefacetrile, cefotaxima (27 l). La diffusione nel liquor è relativamente scarsa; tuttavia, le cef3 presentano il vantaggio rispetto alle cef1 e 2 (ad eccezione della cefuroxima) di assicurare concentrazioni liquorali batteriologicamente attive e questo grazie alla loro attività batterica intrinseca molto alta (ad eccezione del cefoperazone, cefamandolo, cefalotina) e dell’ottimo quoziente di inibizione (rapporto tasso liquor/MIC). La diffusione intraoculare e nella prostata è insufficiente.
8) Eliminazione renale
Si realizza sia attraverso la sola filtrazione glomerulare: cefaloridina, ceftazidima latamoxef, flomoxef, ceftriaxome, cefodizima, cefoperazone, cefsulodina, cefetamet, cefepime, cefpirone, sia per filtrazione glomerulare più secrezio ne tubulare; in questo caso la somministrazione associata di probenecid aumenta il tasso sierico e l’emivita plasmatica delle cefalosporine e riduce la loro clearance renale (la secrezione tubulare è predominante soprattutto con le cefalosporine di prima e seconda generazione ad eccezione della cefaloridina, la cefotaxima, cefmenoxima, ceftizoxima cefotetan, cefuroxima, cefonicid, ceftibuten, cefprozil, loracarbef, cefalexina. La clearance renale esprime la veloci tà della loro eliminazione renale. Essa è bassa, inferiore alla clearance della creatinina con il cefoperazone (18-25), ceftriaxone (8-10), cefpiramide (5), cefotetan (30), latamoxef (60), ceforanide (35), cefonicid (15), cefazolina (60-70), cefodizima (30-35). Essa si avvicina alla clearance della creatinina con la ceftizoxima (110), cefuroxima (135), ceftazidima (90-100), cefsulodina (90-110), cefaloridina (125), cefepime (120) ed è invece superiore alla clearance della creatinina con le cefalosporine di prima generazione, col cefacetrile (330), cefalexina (230), cefalotina (270), cefradina (350), cefaclor (250-300), cefapirina (350), cefamandolo (160), cefotiam (240), cefoxitina (280), cefmenoxima (180). La differenza tra la clearance totale e clearance renale esprime l’eliminazione extrarenale che può essere dovuta sia alla biotrasformazione metabolica sia all’eliminazione epato-biliare. La percentuale di eliminazione nelle urine delle 24 ore è alta per la maggior parte delle cefalosporine (70-100%) ed il loro tasso urinario è molto elevato, superiore 1000 µg/ml ad eccezione della cefalosporine a forte eliminazione epato-biliare. Le cefalosporine sono dializzabili (% di estrazione: 40- 50%), dialisi che può raggiungere, per le cefalospo-rine scarsamente legate alle proteine plasmatiche, il 60% (cefotaxima) o l’80% (ceftazidima); questo rende necessario somministrare una nuova dose dopo una seduta emodialitica. Le cefalosporine fortemente legate alle proteine plasmati-che: cefpiramide, cefixima, cefamandolo, cefonicid, cefoperazone, ceftriaxone non sono dializzabili.
Tossicità ed effetti indesiderati
Come per tutte le beta-lattamine, le cefalosporine sono molto poco tossiche. Tuttavia, un certo numero di effetti collaterali possono comparire durante il trattamento.
a) Intolleranza locale
L’iniezione im di certe cefalosporine (cefalotina, cefoxitina) sono dolorose e la maggior parte delle cefalosporine iniettabili per questa via sono preparate con l’aggiunta di un anestetico locale (lidocaina). Le iniezioni o le infusioni iv possono provocare delle flebiti locali, soprattutto con le cefalosporine in soluzioni con un pH molto acido o molto alcalino. La cefaloridina e la cefuroxima hanno una migliore tolleranza “venosa”, la cefalotina e la cefoxitina provocano più spesso reazioni delle pareti venose.
b) Reazioni allergiche
Nel loro insieme le reazioni cutanee allergiche legate all’uso delle cefalosporine (1-3%) sono meno frequenti e meno severe che con le penicilline, ma le reazioni febbrili dopo perfusione iv sono relativamente frequenti. Lo shock anafilattico è un evento eccezionale, tuttavia lo si è segnalato recentemente col cefaclor (via orale). La sensibilità crociata con le penicilline è documentata nel 5-10% dei casi.
c) Effetti sulla crasi ematica
Si è segnalato nel corso del trattamento: eosinofilia, neutropenia (ma per quest’ultima più raramente che con le penicilline), trombocitopenia (eccezionalmente) e, molto più spesso, trombocitosi latente. Certe cefalosporine possono provocare diatesi emorragica, sia per disfunzione piastrinica dose- e tempo-dipendente (latamoxef, dovuta alla funzione alfacarbossilica su C10, per analogia con la carbossipenicillina che provoca lo stesso fenomeno; fattori favorenti: insufficienza renale, dosi elevate) sia per ipoprotrombinemia legata all’alterazione della sintesi della protrombina, dovuta all’inibizione della gamma- carbossilazione dell’acido glutammico, tappa preliminare per la sintesi della protrombina. L’effetto ipoprotrombinizzante è caratteristico delle cefalosporine che presentano una sostituzione N-metiltiotetrazolo in C3 (Figu-ra 3.13). Fattori favorenti: malnutrizione, alimentazione parenterale, dosi elevate e trattamento prolungato, insufficienza renale, somministrazione associata a medicamenti potenzialmente in grado di indurre disfunzione piastrinica (ASA). La correzione dell’ipoprotrombinemia comporta la somministrazione a scadenza settimanale di vitamina K (10 mg) ed il controllo del tempo di Quick durante il trattamento. Le cefalosporine che posseggono in un nucleo MTT sostituito (cefotiam, cefonicid, ceforanide), non sembrano indur-re disfunzioni emorragiche. Un test di Coombs positivo, latente e reversibile, senza emolisi, si osserva spesso, ma i casi di anemia emolitica sono molto rari.
d) Effetti epato-biliari
Un aumento moderato e transitorio delle transaminasi e della fosfatasi alcalina (che possono evolvere eccezionalmente fino alla colestasi) si può osservare soprattutto con le cefalosporine a forte eliminazione epato-biliare. Il ceftriaxone è la sola cefalosporina che può avere un effetto litogenico biliare e provocare dei quadri di colecistite o di pseudolitiasi biliare reversibile, soprattutto nei bambini (dosi elevate, trattamento prolungato).
CEFOPERAZONE
![]() S
NNC2H5N
S
NNC2H5N
![]() NCONHCHCONH
NCONHCHCONH
![]()
![]() NNOO
O CH2S
NNOO
O CH2S
![]() N
N
COOH CH3OH
CEFOTETAN COOH
![]()
![]() S
S
![]() OCHS
OCHS
3
C=C CHCONH NNHNOC
2S
![]() NN
NN
O
CHS N
2
COOH
CH
3
LATAMOXEF
![]()
![]() OCH3
OHO CHCONH NN
OCH3
OHO CHCONH NN
![]()
![]() NCOOH
N
NCOOH
N
O
CH2S N
COOH CH3CEFAMANDOLO
![]()
![]() SCHCONH
NN
SCHCONH
NN
![]()
![]() N
N
OH N
O
CH2S
N COOH
CH3 CEFMETAZOLO
![]() OCH3
SNCCH2SCH2CONH
OCH3
SNCCH2SCH2CONH
NN
![]()
![]() NN
NN
O
CH2S
N COOH
CH3
Figura 3.13 Cefalosporine che possono provocare episodi emorragici o reazioni tipo- disulfiram: sostituzione metil-tiotetrazolica non sostituita in C3.
e) Disturbi gastroenterici
Si osservano soprattutto con le cefalosporine a forte eliminazione biliare (cefoperazone, ceftriaxone ) sotto forma di diarrea benigna, relativamente frequente (soprattutto con il cefoperazone), o eccezionalmente come colite acuta pseudomembranosa (per selezione del Clostridium difficile).
f) Nefrotossicità delle cefalosporine
La nefrotossicità delle cefalosporine è limitata alla cefaloridina (il suo carattere zwitterionico fa sì che essa non sia eliminata per secrezione tubulare e questo comporta un accumulo ed una concentrazione tubulare dose- dipenden-te). L’effetto nefrotossico è molto meno evidente con la cefalotina, quando sono presenti fattori favorenti: dosi elevate, trattamento prolungato, patologia renale preesistente, associazione con altri antibiotici o medicamenti nefrotossici: aminosidi, diuretici dell’ansa, ciclosporina. etc.
g) Sovraccarico di sodio, ipokaliemia
Si riscontrano molto raramente con le cefalosporine (contrariamente che con le penicilline disodiche), anche utilizzandole come sali disodici (cetriaxone, latamoxef, cefonicid, cefotetan, cefodizime) o con le cefalosporine solubilizzate in soluzione al bicarbonato disodico (cefmenoxime, cefotetan, cefamandolo), per il fatto che le dosi giornaliere sono molto inferiori rispetto a quelle di certe penicilline (penicillina G, carbossipenicilline, ureidopencilline).
h) Neurotossicità
Una neurotossicità, che si esprime con convulsioni, disartria, mioclonia, confusione mentale (encefalopatia) può essere a volte osservata (ma più raramente che con le penicilline) quando siano contestualmente presenti dei fattori favorenti: dosi elevate, insufficienza renale, somministrazione intrarachidea o intraventricolare.
i) Reazioni vascolari tipo disulfiram
Le reazioni vascolari tipo disulfiram, scatenate dalla concomitante assunzione di alcolici, si verificano solo con alcune cefalosporine (sostituzione N-metil-tiotetrazolo in C3). Tale rischio persiste per 48 ore dopo la sospensione delle cefalosporine.
j) Effetti perturbanti l’equilibrio della flora intestinale
Si riscontrano soprattutto con le cefalosporine a forte eliminazione biliare: colonizzazione digestiva ad opera di germi patogeni, sovrainfezioni nel corso del trattamento con enterococchi, Pseudomonas, Acinetobacter, Candida.
k) Carenza di carnitina con le cefalosporine orali esterificate
Indicazioni cliniche
1) Cefalosporine di prima generazione
a) Cefalosporine orali: sono utilizzate soprattutto per il trattamento delle infezioni respiratorie: otiti, sinusiti, bron-chite acuta, pneumopatie della comunità sostenute da germi sensibili: pneumococchi, streptococchi, Haemophi-lus. Per quest’ultimo preferire il cefaclor, loracarbef o cefprozil. Utili nel trattamento delle infezioni delle basse ed alte vie urinarie sostenute da germi sensibili, ad eccezione degli enterococchi. Per quanto riguarda queste due indicazioni, le cefalosporine orali entrano in competizione con la penicillina V e con le aminopenicilline, anche associate ad un’inibitore delle beta-lattamasi, per le infezioni respiratorie, e con il cotrimoxazolo (o il trimetoprim) ed i fluorochinoloni per le infezioni urinarie. Trattamento delle le infezioni da bacilli Gram negativi resistenti alle aminopenicilline (Klebsiella). Per alcune cef1 orali (cefadroxil) è stata riportata un’azione sul sistema immunitario consistente in un’inibizione della sintesi delle IgE.
b) Le cefalosporine di prima generazione a somministrazione parenterale sono utilizzate soprattutto nel trattamento delle infezioni da stafilococchi (con l’eccezione dello stafilococco meti-R e delle meningiti da stafilococchi) e profilassi chirurgica di breve durata (chirurgia ortopedica, cardiaca, etc.).
2) Cefalosporine di seconda generazione
Le cefalosporine di seconda generazione hanno più o meno le stesse indicazioni di quelle di generazione precedente, ma con qualche indicazione supplementare legata al loro ampio spettro ed alla loro attività intrinseca più alta: -trattamento delle infezioni delle vie urinarie alte da germi resistenti alle aminopenicilline (ma per questa indica
zione sono attualmente superate dalle cefalosporine di terza generazione, i monobattamici, i fluorochinoloni, gli
aminoglicosidi). -trattamento delle infezioni da stafilococchi meti-S: cefamandolo, cefaloxima, cefotiam. -trattamento delle infezioni postsplenectomia da pneumococchi ed Haemophilus. -trattamento delle infezioni miste da anaerobi-aerobi: infezioni intraddominali, dopo chirurgia digestiva o gine-
cologica: cefamicine. Per questa indicazione esse sono in competizione con le ureidopenicilline (attività superiore
e più costante), con l’amoxicillina/ac. clavulanico, con i nitroimidazoli e la clindamicina. -trattamento delle infezioni respiratorie (pneumococchi, H. influenzae, Branhamella): cefuroxima, cefotiam. -trattamento della gonococcia: cefuroxime, cefamandolo, cefotetan, cefoxitina etc. (ma sono in competizione con
numerose altre beta-lattamine, fluorochinoloni, etc.). Sono poco attive sulla gonococcia faringea. -profilassi di breve durata pre e postoperatoria: chirurgia ortopedica, cardiovascolare, colon-rettale, ginecologica.
3) Cefalosporine di terza generazione
a) Cefalosporine orali: sono utilizzate per il trattamento ambulatoriale delle infezioni ORL, respiratorie ed urinarie sostenute da germi resistenti alle cefalosporine di generazioni precedenti. In particolare, nei soggetti a rischio (alcolisti, fumatori, anziani) esse potrebbero sostituire il trattamento iniziale con le cefalosporine parenterali per un’infezione severa. Esse entrano in competizione con le cefalosporine orali di prima e seconda generazione e con l’amoxicillina/ac. clavulanico.
-trattamento dei morsi di animali (Pasteurella).
b) Cef3 a somministrazione parenterale: le loro indicazioni attuali sono molto ampie ma la maggior parte di esse entrano in competizione con le carbossi- e le ureidopenicilline (da sole o in associazione con inibitori delle beta- lattamasi), con i monobattami e l’imipenem, con i fluorochinoloni etc.
-infezioni gravi da bacilli Gram negativi: setticemie, endocardite, meningite, sia in monoterapia (germi molto sensibili e sistema immunitario intatto) sia associate ad un aminoside: germi meno sensibili (Pseudomonas, Acinetobacter, Serratia, Enterobacter, Citrobacter, Providencia, Proteus indolo positivo), soprattutto nei pazienti immunodepressi, neutropenici etc.
-per lo Pseudomonas va preferita una cefalosporina anti-Pseudomonas (preferibilmente ceftazidima) o l’aztreonam associata ad un’aminoside.
-per l’Acinetobacter va preferita la ceftazidima (oppure imipenem + cilastatina)
-trattamento delle meningiti nosocomiali da bacilli Gram negativi, in particolare su materiale neurochirurgico (enterobatteri): ceftazidima, ceftizoxima, cefotaxima.
-trattamento delle meningiti nei bambini da Haemophilus produttore di penicillinasi.
-trattamento delle meningiti neonatali (H. influenzae, Listeria, Streptococcus B).
-trattamento delle meningiti da stafilococchi, anche meti-R: cef3 più fosfomicina. Nel trattamento delle meningiti pneumococciche sono da evitare latamoxef e cefoperazone. Da sottolineare che nessuna cef3 è attiva per il trattamento delle meningiti da Listeria nel bambino.
-Profilassi delle menigiti meningococciche.
-trattamento della pielonefrite nosocomiale sostenuta da enterobatteri pluriresistenti: da preferire la monoterapia se non si hanno anomalie urologiche sottostanti. È il solo trattamento possibile nelle donne incinte.
-trattamento delle pneumopatie nosocomiali o della comunità sostenute da Klebsiella (alcolisti, immunodepressi)
-trattamento delle polmoniti ab ingestis (in associazione con metronidazolo)
-trattamento delle osteomieliti da bacilli Gram negativi: ceftazidima, cefotaxime, latamoxef, ceftizoxime, ceftriaxone.
-trattamento delle infezioni sistemiche (setticemie) in pazienti neutropenici: ceftazidima (enterobatteri, Pseudo-monas) più aminoside più, eventualmente, vancomicina.
-Quando si tratta di infezioni nosocomiali da germi produttori di beta-lattamasi ad ampio spettro o di mutanti attivati iperproduttori di cefalosporinasi bisogna preferire il latamoxef, resistente all’idrolisi operata da queste beta-lattamasi.
-trattamento delle colangiti e delle asciti infette: preferire le cefalosporine a forte eliminazione biliare.
-trattamento delle salmonellosi: ceftazidima, ceftriaxone, cefoperazone, cefotaxime, permette l’abbreviazione del trattamento (in competizione con i fluorochinoloni).
-trattamento d’attacco empirico delle infezioni severe (in attesa dell’isolamento del germe) soprattutto nei pazienti immunodepressi (in associazione con un aminoside)
-trattamento delle infezioni da Pasteurella
-trattamento delle infezioni miste aerobi-anaerobi: latamoxef (ma 10% di resistenza per gli anaerobi; questo fa preferire le ureidopenicilline associate ad un inibitore delle beta-lattamasi o ad un nitroimidazolo)
-trattamento delle gonococcie genitali o extragenitali (faringea, congiuntivite neonatale): ceftriaxone 250 mg im (ma in competizione con numerosi antibiotici orali) e non agisce su Chlamydia - Mycoplasma. Per questi ultimi è da preferire un fluorochinolone o un macrolide.
-trattamento della sifilide primaria e secondaria: ceftriaxone 4 g in due sommministrazioni
-trattamento dell’ulcera molle (H. ducrey): ceftriaxone 500-1000 mg in dose unica
-trattamento della malattia di Lyme.
-si potrebbero utilizzare, con molta prudenza, nel trattamento delle infezioni gravi nei soggetti allergici alle penicilline.
-sono state proposte anche nell’antibiotico profilassi pre e postoperatorie, nella chirurgia gastroenterica, ginecologica, urologica: ceftazidima.
Le cef3 non sono attive nel trattamento delle infezioni da: stafilococco meti-R, enterococco, Listeria, Brucella,
Yersinia, Campylobacter e germi intracellulari privi di parete.
Controindicazioni e precauzioni d’uso
Allergia alle cefalosporine e, per le cefalosporine iniettabili per via im contenenti la lidocaina, allergia alla lidocaina
e nei bambini con meno di tre mesi di età.
Cefaloridina: insufficienza renale
Precauzioni d’uso:
-monitorare la funzione renale soprattutto in caso di associazione con aminosidi od altri antibiotici o medicamen-ti nefrotossici (diuretici dell’ansa, etc.). In caso di insufficienza renale ridurre ed adattare la posologia in funzione della creatininemia, ad eccezione delle cefalosporine che hanno un’eliminazione biliare molto importante: ceftriaxone, cefotetan, cefixime che non richiedono una riduzione della posologia in caso di lieve insufficienza renale.
-In caso di allergia alle penicilline tenere conto del rischio di allergie crociate che è pari al 5-10% dei casi; prudenza e sorveglianza medica, soprattutto dopo la prima somministrazione. Sconsigliate durante l’allattamento in quanto passano nel latte materno. Per le cefalosporine contenenti un gruppo N- metiltiotetrazolo non sostituito in C3, evitare assolutamente l’associazione con anticoagulanti orali, sorvegliare i parametri della coagulazione (test di Quick), somministrare vitamina K a titolo profilattico in caso di trattamento prolungato ad alte dosi, evitare bevande o medicamenti alcolici durante e fino a 2-3 gioni dopo la fine del trattamento (tenere conto che esistono numerose soluzioni medicamentose iniettabili o assumibili per os preparate con alcol etilico come solvente).
-Per le cefalosporine a prevalente eliminazione epato-biliare ridurre la posologia in caso di insufficienza epatica, soprattutto in presenza di insufficienza renale associata, interrompere il trattamento in caso di diarrea severa (rischio di colite acuta pseudomembranosa). Per il ceftriaxone è necessaria la sorveglianza ecografica epato-biliare soprattutto nei soggetti portatori di litiasi biliare.
-Nei neonati evitare le cefalosporine che si legano fortemente alle proteine plasmatiche.
Interazione farmacologiche
Interazioni utili (Tabella 3.22) -con gli aminoglicosidi: Pseudomonas, Acinetobacter, enterobatteri, stafilococchi (ma rischio aumentato di nefrotossicità soprattutto con la cefaloridina e la cefalotina). -con la fosfomicina: stafilococchi anche meti-R: esempio cefotaxime più fosfomicina nel trattamento delle me-ningiti o infezioni ossee da stafilococchi; oppure cefalosporine più antipseudomonas più fosfomicina nel tratta-mento delle infezioni da Pseudomonas. -con gli inibitori delle beta-lattamasi, esempio cefoperazone. -con altre beta-lattamine scarsi induttori di betalattamasi: esempio ceftazidima più ureidopenicilline (Pseudomonas). -con le aminopenicilline nel periodo neonatale (meningiti) al fine di coprire anche Listeria ed enterococco. -con i fluorochinoloni (effetto addittivo più prevenzione dello sviluppo della resistenza): enterobatteri, Pseudomonas, stafilococchi, Legionella. Esiste anche un doppio estere: cefalosporina in C7 con un fluorochinolone in C3.
-con i nitroimidazoli: infezioni miste aerobiche-anaerobiche, polmoniti ab ingestis.-con i calcioantagonisti (nifedipina, ecc.): aumento della biodisponibilità di alcune cefalosporine orali (cefixime).Interazioni da evitare (Tabella 3.23)Con altri antibiotici:
evitare l’associazione delle cefalosporine scarsamente
induttrici di beta-lattamasi (cef3 e cef4) con le beta-lattamine
forti induttrici di beta-lattamasi: cefamicine e imipenem.Con
altri farmaci:-cefalosporine (soprattutto cefaloridina e
cefalotina) con i diuretici dell’ansa (aumento della
nefrotossicità).-cefalosporine ad effetto ipoprotrombizzante che
presentano una sostituzione di N-metiltiotetrazolo in C3)
con gli
anticoagulanti orali, ASA (aumentato rischio di emorragie) e con le soluzioni farmaceutiche contenenti alcool etilico (reazioni tipo disulfiram). -cefpodoxime, proxetil, cefuroxime axetil: con antiacidi ed anti-H2 (diminuzione della biodisponibilità).
Modalità di somministrazione e posologia (Tabella 3.24)
Cefalosporine orali
Sono utilizzate sotto forma di compresse capsule, bustine e sciroppo. Le cefalosporine esterificate in C3 (profarmaci) sono somministrate a stomaco pieno; ciò aumenta il loro assorbimento digestivo. La maggior parte delle cefalospo-rine orali hanno una breve emivita e sono somministrate in 3-4 assunzioni giornaliere. Solo le cefalosporine con emivita superiore ad 1 ora (Cefadroxil, cefatrizina, cefuroxime, axetil) e soprattutto la cefixima (emivita di 3-4 ore) sono somministrate in due dosi giornaliere.
Cefalosporine a somministrazione parenterale
Sono somministrate per via intramuscolare od endovenosa. Per via im si dispone di flaconi da 0.5 a 2 g in polvere. La maggior parte delle cefalosporine somministrate per questa via utilizzano come solvente una soluzione di lidocana (cloridrato) allo 0.5 o all’1%. L’iniezione deve essere effettuata in profondità nella regione glutea. È raccomandato di non iniettare più di 1 g dallo stesso lato. La posologia media nell’adulto è 2-4 g per le cef1 e cef2 e di 1-3 g per le cef3. Per via ev le soluzioni sono preparate estemporaneamente e possono essere iniettate direttamente (bolo) in vena lentamente (2-4 minuti) o in perfusione venosa lenta in 50-100 ml di solvente isotonico. Evitare di iniettare nello stesso deflussore una cefalosporina e un aminoside (rischio di inattivazione diretta dell’aminoside da parte della cefalosporina). Questo rischio di inattivazione è tuttavia molto più basso che con le penicilline. In pratica, lo si evita completamente iniettando i due antibiotici in due vie venose differenti. Evitare anche di mescolare nello stesso
flacone di perfusione di soluzioni
medicamentose incompatibili, sia molto acide (esempio
dipiridamolo) sia molto
alcaline (bicarbonato di sodio, trometamolo, barbiturici,
teofillina) o con soluzioni di aminoacidi, diidrolissati
proteici,
di emulsioni lipidiche, etc.
Le altre vie di somministrazione: sottocongiuntivale,
intrasinusoidale, per instillazione vescicale, etc, sono
possibili
con le cefalosporine che posseggono una buona tolleranza locale.
Ridurre la posologia giornaliera in caso di insufficienza
renale.
4) Cefalosporine di quarta generazione a somministrazione parenterale (catena di ammonio quaternario in C3, zwitterioni)
Il loro spettro d’azione si distingue da quello della cef3 per un’attività equilibrata tra i cocchi Gram positivi e gli enterobatteri, anche produttori di cefalosporinasi cromosomiche attivati o di beta-lattamasi indotte a largo spet-tro: Enterobacter cloacae, Citrobacter, Serratia, P. stuartii, resistenti alle cef3. Sui cocchi Gram positivi la loro buona attività è comparabile a quella delle cef1 e cef2 (ad eccezione della cefalidina). L’attività su Pseudomonas aerugino-sa è equivalente o molto poco inferiore a quella della ceftazidima. La loro attività, superiore a quella delle cef3, è dovuta ad una maggiore permeabilità attraverso la membrana grazie ad una più alta velocità di penetrazione attraverso la parete batterica per la presenza del gruppo ammonio quaternario in C3. Germi resistenti alle cef4: stafilococchi meti-R, Listeria, Bacteroides, germi intracellulari senza parete.
Prospettive future
Le ricerche volte ad ottenere nuove cefalosporine vanno probabilmente dirette in più direzioni:
-sintesi di cefalosporine ancora più stabili alle beta-lattamasi recenti: penicillinasi ad ampio spettro delle Klebsielle, cefalosporinasi cromosomiche dei classe I di mutanti attivati stabili di Enterobacter, Citrobacter, Serratia, etc, che posseggano la capacità di indurre le beta-lattamasi.
-ottenere delle cefalosporine anti-Pseudomonas ed anti-Acinetobacter più attive di quelle attuali.-ottenere cefalosporine con attività rinforzata anti-anaerobi, attive parimenti su Clostridium difficile.-ottenere delle cefalosporine ad attività rinforzata sui cocchi Gram positivi ed in particolare sugli stafilococchi
meti-R, gli enterococchi e gli pseudomonas a sensibilità ridotta o resistenti del tutto alle penicilline. La realizzazione di una monoterapia alternativa agli aminosidi resta per il momento ancora un obiettivo da raggiungere.
3.4 CARBAPENEMI E PENEMI
Queste due nuove classi di beta-lattamine sono attualmente in pieno sviluppo ed hanno già conquistato un ruolo importante nel trattamento delle infezioni nosocomiali severe, da germi multi-resistenti in ambiente ospedaliero.
Carbapenemi
I carbapenemi, rappresentati all’inizio da un solo prodotto, l’imipenem, derivato stabile della tienamicina, si sono sviluppati successivamente in altri composti a somministrazione esclusivamente parenterale riservati per l’uso ospedaliero come il meropenem ed una dozzina di molecole in corso di studio finalizzate a: -rinforzare l’attività sugli stafilococchi meti-R, gli enterococchi, gli pneumococchi resistenti alla penicillina, da
una parte, e sullo Pseudomonas aeruginosa resistente ai carbapenemi attuali, dall’altra; -aumentare la resistenza dei carbapenemi all’idrolisi da parte delle deidropeptidasi renali al fine di poterli utilizza-
re senza doverli associare ad un inibitore delle deidropeptidasi; -ridurre la neurotossicità (effetto convulsivante) del primo carbapeneme, l’imipenem, nel trattamento delle meningiti. Attualmente si dispone di due categorie di carbapenemi: 1) carbapenemi associati ad un inibitore delle deidropeptidasi renali, la cilastatina (imipenem + cilastatina) 2) carbapenemi utilizzati da soli senza associarli ad un inibitore delle deidropeptidasi renali (carbapenemi che pre
sentano una sostituzione metilica in posizione 1-b): meropenem, etc. I carbapenemi hanno apportato molti vantaggi importanti rispetto alle altre beta-lattamine: -uno spettro antibatterico molto ampio, il più ampio tra quelli riscontrati tra le beta-lattamine, includente i cocchi
Gram positivi, compresi, per alcuni di essi, gli stafilococchi meti-R e gli enterococchi, i cocchi Gram negativi (Neisseria), i bacilli Gram positivi, tra cui la Listeria e la Nocardia (resistenti alle cefalosporine), gli Haemophilus e Branhamella catarrhalis, gli anaerobi Gram positivi e Gram negativi;
-un’azione battericida rapida dovuta ad un attraversamento veloce attraverso le porine D2 della parete batterica;-una modalità d’azione differente, per fissazione elettiva sulle PBP2 e PBP1;-una grande stabilità all’azione idrolitica operata da tutte le beta-lattamasi plasmidiche e cromosomiche, com-
prese le beta-lattamasi a largo spettro (Klebsiella) e le cefalosporinasi di classe I dei mutanti attivati iperproduttori di queste cefalosporinasi: Enterobacter, Citrobacter, Serratia, Morganella, Pseudomonas, che inattivano le cef3;
-benché resistenti all’idrolisi di tutte le beta-lattamasi, i carbapenemi sono allo stesso tempo potenti induttori delle beta-lattamasi cromosomiche che inattivano le beta-lattamine idrolizzate da queste beta-lattamasi: aztreonam, cef3, ureidopenicilline, penicilline antistafilococciche. Bisogna quindi evitare l’associazione di queste classi di beta-lattamine;
-un effetto inoculo estremamente ridotto, ad eccezione dei germi iperproduttori di cefalosporinasi di classe I; -una buona azione su Pseudomonas, anche sui ceppi quiescenti (contrariamente alle altre beta-lattamine). Questa azione sui ceppi quiescenti è tuttavia assente con gli stafilococchi; -azione concentrazione dipendente (tutte le altre beta-lattamine hanno un’azione tempo dipendente). Tuttavia,
su Pseudomonas, l’azione dei carbapenemi è tempo dipendente. -assenza di resistenza crociata con le penicilline e cefalosporine anti-Pseudomonas; -effetto postantibiotico sui cocchi Gram positivi ed i bacilli Gram negativi (le altre beta-lattamine non presentano
effetti post antibiotico per i bacilli Gram negativi).
Grazie a tutte queste qualità, i carbapenemi costituiscono attualmente il trattamento “eroico” delle infezioni ospe-daliere severe da germi multiresistenti in soggetti immunodepressi e neutropenici. Sono in competizione, in queste patologie, con le cef3 e 4 e con i fluorochinoloni.
In rapporto alle cef3, i carbapenemi fanno rientrare nel loro spettro antibatterico:-i mutanti attivati iperproduttori di cefalosporinasi (Enterobacter, Citrobacter, Serratia, Morganella, Pseudomonas);-i germi produttori di beta-lattamasi ad ampio spettro;-gli Pseudomonas resistenti alle altre beta-lattamine;-Acinetobacter, attualmente poco sensibile o resistente alle penicilline e cefalosporine anti-Pseudomonas;-Listeria e Nocardia non sensibili alle cefalosporine;-tutti gli anaerobi Gram positivi e Gram negativi.
Composizione chimica
Il primo carbapeneme, la tienamicina, è stata ottenuto da Streptomyces cattley, ma siccome questo prodotto si è rivelato molto instabile, si utilizza oggi un suo derivato stabilizzato, l’N-formimidoyl-tienamicina (imipenem) (Figu ra 3.14). Poiché quest’ultimo è idrolizzato ed inattivato da due enzimi (deidropeptidasi I) che si trovano nell’orletto a spazzola delle cellule del tubulo renale prossimale, si associa in un rapporto 1/1 con un inibitore competitivo delle deidropeptidasi, la cilastatina. L’associazione della cilastatina all’imipenem determina molti effetti favorevoli: -la cilastatina inibisce la biotrasformazione metabolica dell’imipenem in metaboliti inattivi e più tossici e questo
comporta un aumento significativo dell’eliminazione renale in forma attiva, non metabolizzata, che passa dal
30%, senza cilastatina, al 70% con la cilastatina. -si ottiene una diminuzione della nefrotossicità. -infine, la cilastatina provoca, per competizione, una inibizione della secrezione tubulare dell’imipenem (effetto
tipo probenecid) che porta, come conseguenza, ad un aumento dei tassi ematici e dell’AUC dell’imipenem oltre ad
una riduzione della sua clearance renale, per blocco della secrezione tubulare. Il meropenem (Figura 3.14) è un carbapeneme per uso parenterale, stabile alla deidropeptidasi-1 renale umana (DHP-1). I carbapenemi differiscono sul piano chimico dai penemi (penicilline) per la presenza di un doppio legame C2-C3, per la sostituzione di un atomo di S con un atomo di C nell’anello tiazolidinico, per l’alchilazione diretta della catena idrossietilica in configurazione trans su C6 (tutte le altre beta-lattamine presentando una configurazione cis). Tutte queste strutture assicurano la grande stabilità dei carbapenemi nei confronti di tutte le beta-lattamasi. La sostituzione in C è variabile:
2
-cisteamina (imipenem); -tiopirrolidina (meropenem).
Meccanismo d’azione
Fissazione elettiva sulle PBP 2 e, con l’aumentare della concentrazione, sulle PBP 1a e b e quindi sulle PBP 3. Sul piano morfologico questo porta alla formazione di cellule batteriche rotondeggianti o globose. Ricordiamo che le cefalosporine hanno una fissazione elettiva sulle PBP 3. L’effetto è rapidamente battericida grazie alla loro velocità di penetrazione attraverso le porine della cellula batterica, porine diversi da quelli utilizzati dalle altre beta-lattamine.
IMIPENEM CILASTATINA COOH
![]() NH2SCH2
NH2SCH2
 O
O
N
CH
HC SCH![]() 2
CH2 NH CH=NH
2
CH2 NH CH=NH
![]() (CH2)4
(CH2)4
![]() COOH
COOH
3
H HH
HN
O OH
H COOH
MEROPENEM
![]() CH3
CH3
COOH
![]() H
CON
H
CON
CH3 O
N
O
N
S
NHH3C HHCH3 H H O H
Figura 3.14 Formula di struttura dei carbapenemi.
L’effetto battericida si esplica tanto sui batteri in fase di crescita che su quelli in fase di quiescenza ed è concentra-zione dipendente, almeno per Pseudomonas aeruginosa, contrariamente a quanto accade per le altre beta-lattamine il cui effetto battericida è tempo dipendente. I carbapenemi sono resistenti all’idrolisi operata da tutte le beta-lattamasi, comprese quelle ad ampio spettro e quelle cromosomiche di mutanti attivati appartenenti al gruppo dei bacilli Gram negativi, ma allo stesso tempo essi sono potenti induttori delle beta-lattamasi cromosomiche e plasmidiche. Altri caratteri distintivi rispetto alle altre beta-lattamine: -effetto postantibiotico (PAE) tanto sui batteri Gram negativi che Gram positivi (le altre beta-lattamine non hanno
un’effetto postantibiotico sui bacilli Gram negativi); -effetto inoculo nullo o minimo per i germi sensibili. Lo spettro antibatterico è estremamente ampio ed include: -i cocchi aerobi Gram positivi: streptococchi, pneumococchi anche a sensibilità ridotta, enterococco fecale, stafi
lococco meti-S (certi carbapenemi recenti possono avere una qualche attività anche sugli stafilococchi meti- R); -cocchi Gram negativi, Neisseria. Da notare che Neisseria (gonococco) è meno sensibile ai carbapenemi (MIC 2 µg/ml) che alle altre beta-lattamine. I meningococchi sono estremamente sensibili ai carbapenemi. I bacilli aerobi Gram positivi: Listeria e Nocardia (resistente alle cefalosporine), Erysipelothrix rusiopathiae; -bacilli Gram negativi: Enterobatteri: E.coli, Proteus mirabilis ed indologenico, Providencia, Hafnia, Serratia, En-
terobacter, Citrobacter, Pseudomonas aeruginosa (compreso i mutanti attivati iperproduttori di cefalosporinasi di classe I), Klebsiella, compresi i ceppi produttori di beta-lattamasi a spettro ampio, Salmonella, Shigella, Campylo-bacter, Acinetobacter (i carbapenemi sono attualmente i più regolarmente attivi su Acinetobacter, germe nosoco-miale difficile), Aeromonas hydrophila, Yersinia.
Per lo Pseudomonas aeruginosa e l’Acinetobacter non ci sono resistenze crociate con le altre beta-lattamine anti-Pseudomonas.-altri bacilli Gram negativi: Branhamella catarrhalis, H. influenzae, Pasteurella, Bordetella, Brucella, Gardnerella.Tutti gli anaerobi Gram positivi e Gram negativi:-anaerobi Gram negativi: Bacteroides, Fusobacterium, Veillonella.-anaerobi Gram positivi: Actinomyces, Clostridium perfringens (Clostridium difficile è certe volte sensibile ad alcu-
ni carbapenemi recenti), Eubacterium, Peptococco e Peptostreptococco, Propionibacterium. Germi resistenti: Xanthomonas maltophilia e cepacia (cepacia può essere relativamente sensibile al meropenem), stafilococco meti-R, Enterococcus faecium, Flavobacteriunm meningosepticum, Corynebacterium J K, Clostridium difficile (imipenem), Mycobacterium e tutti i germi intracellulari sprovvisti di parete: Chlamydia, Mycoplasma, Rickettsia etc.
La resistenza batterica ai carbapenemi si realizza almeno attraverso
due meccanismi: idrolisi da parte delle
carbapenemasi ed impermeabilità delle porine D2 della
membrana esterna utilizzati dai carbapenemi.Qualche particolarità
riguardo lo spettro antibatterico dei carbapenemi:-contrariamente alle
altre beta-lattamine anti-Pseudomonas, attive sullo
Pseudomonas e sull’Acinetobacter, i
carbapenemi sono più attivi su quest’ultimo microrganismo che sullo Pseudomonas. -Tra i carbapenemi l’imipenem presenta, sui batteri Gram negativi, una maggiore attività rispetto al meropenem. -Proteus ed Haemophilus sono meno sensibili (MIC più alte) che alle penicilline a largo spettro e alle cef3. -Neisseria gonorrheae (moderatamente sensibile) e meningitidis (estremamente sensibile) presentano una sensi-
bilità molto contraddittoria -L’attività antibatterica rispetto all’E. faecalis è risultata essere di gran lunga migliore quella dell’ imipenem rispet
to al meropenem; infatti, la MIC90 è stata pari a 8 mg/l per il meropenem ed appena pari a 2 mg/l per l’imipenem. Le MIC dei batteri Gram positivi e degli anaerobi sono più basse che per gli enterobatteri. Specie molto sensibili: MIC < 0.5 µg/ml. Specie moderatamente sensibili: MIC < 4 µg/ml. Specie resistenti: MIC > 6 µg/ml. I meccanismi della resistenza batterica ai carbapenemi sono molteplici: -assenza delle porine D2 nella parete batterica che assicurano la permeabilità ed il trasporto nello spazio periplasmico
della membrana batterica (Pseudomonas); -più raramente, ridotta affinità dei carbapemeni per certi PBP: PBP 2 (stafilococco), PBP 4 (Pseudomonas), PBP 5 (enterococco); -iperproduzione di beta-lattamasi cromosomiche inducibili di classe I: Pseudomonas maltophilia, Acinetobacter, Aeromonas, Enterobacter, Bacteroides fragilis;
-fenomeni di tolleranza tra cocchi e bacilli Gram positivi. Molto spesso almeno due di questi meccanismi sono associati ed in particolare si riscontra frequentemente una impermeabilità delle porine associata ad un’iperproduzione di cefalosporinasi. Lo Pseudomonas aeruginosa resistente ai carbapenemi resta sensibile alle penicilline, ai monobattamici, alle cefa-losporine anti-Pseudomonas e viceversa: gli Pseudomonas resistenti a queste beta-lattamine restano sensibili ai carbapenemi (assenza di resistenza crociata). D’altra parte esiste un’antagonismo tra i carbapenemi, forti induttori di beta-lattamasi, e altre beta-lattamine idrolizzate ad opera di tali beta-lattamasi indotte. Nell’insieme la resistenza ai carbapenemi è molto rara e a comparsa più lenta rispetto alle cef 3. Tuttavia, certi germi secretori di carbapenemasi, come Pseudomonas malthophilia ed Aeromonas, sono resistenti ai carbapenemi. I carbapenemi sono delle metallo-β-lattamasi il cui nucleo attivo è un atomo di zinco. Il loro meccanismo d’azione è simile a quello delle deidropeptidasi renali. L’impiego dell’imipenem/cilastatina, infine, oltre a presentare una azione antibatterica più ampia consente anche una sensibile riduzione dei costi legati alla terapia grazie alla minore durata del trattamento ed al minore dosaggio richiesto rispetto al meropenem.
Farmacocinetica (Tabella 3.25) La farmacocinetica è lineare, tanto per i carbapenemi che per la cilastatina. I carbapenemi hanno dei parametri farmacocinetici comuni: emivita breve (intorno ad un’ora) e perciò sono necessarie più somministrazioni quotidia-ne, scarso legame farmacoproteico nel plasma (< 20%), volume di distribuzione (< 20 l) limitato allo spazio extra-cellulare, diffusione nelle secrezioni bronchiali e nel LCR intorno al 20% (ma questo varia a seconda dello stato infiammatorio delle meningi), biotrasformazione metabolica variabile, intensiva per i carbapenemi idrolizzati dalle deidropeptidasi renali (imipenem), ma inibita dagli inibitori delle deidropeptidasi (cilastatina), biotrasformazione metabolica ridotta (20%) per i carbapenemi resistenti all’idrolisi delle deidropeptidasi (meropenem, biapenem). I metaboliti dei carbapenemi sono privi di attività antibatterica e più nefrotossici. La cilastatina è metabolizzata in N-acetil-cilastatina. Eliminazione renale rapida ed elevata nelle urine delle 24 ore. La clearance renale è soggetta a grandi variazioni individuali. L’eliminazione renale si realizza principalmente (80%) per filtrazione glomerulare e il 15% per secrezio-ne tubulare per l’imipenem. La cilastatina viene eliminata soprattutto per secrezione tubulare. I carbapenemi sono dializzabili, e quindi è neces-sario somministrare una dose supplementare dopo ogni seduta emodialitica. In caso di insufficienza renale l’emivita dell’imipenem aumenta leggermente (3-4 h), quella della cilastatina molto di più (17 h), in ragione dell’assenza di metabolismo extrarenale. Ciò che varia da un carbapeneme all’altro sono: -la biotrasformazione metabolica: intensa (imipenem) o scarsa (meropenem); -la clearance renale;
-il meccanismo di eliminazione renale: filtrazione glomerulare e
soprattutto secrezione tubulare.
Nei pazienti con insufficienza renale, l’emivita dell’ imipenem
aumenta sino ad un massimo di 4 ore (mentre l’emi
vita dei metaboliti del farmaco e della cilastatina può aumentare sino a
16 ore); il ridotto incremento dell’emivita
dell’imipenem è probabilmente dovuto ad una spontanea biotrasformazione
della molecola. In questi pazienti l’emivita
del meropenem aumenta invece sino a 7 ore, e quello dei suoi metaboliti
sino a 24 ore. Sia l’imipenem sia i suoi
metaboliti, essendo strutture a basso peso molecolare, sono ben
eliminati dall’emodialisi.
La penetrazione dell’imipenem è ottima in tutti i compartimenti
corporei. Tenendo conto dei valori delle MIC90,
l’attività antibatterica verso i patogeni sensibili è mantenuta in tutti
i tessuti per almeno 4.5 ore.
Tossicità ed effetti indesiderati
I carbapenemi posseggono in comune con le altre beta-lattamine gli stessi effetti indesiderabili, con qualche lievedifferenza riguardo:-intolleranza locale: eritema, infiltrazione infiammatoria, tromboflebite;-reazioni allergiche crociate con le altre beta-lattamine;-disturbi digestivi, fino alla comparsa di colite pseudomembranosa legata alla loro attività sulla flora anaerobica;-disturbi epatici: ipertransaminasemia, bilirubinemia;-disturbi ematologici: leuco-neutropenia, trombopenia, aumento del tempo di Quick, positivizzazione del test di
Coombs diretto; -disturbi renali, soprattutto con carbapenemi idrolizzati dalle deidropeptidasi; -disturbi neuropsichici, più frequenti che con le altre beta-lattamine: mioclonie, convulsioni, stato confusionale,
soprattutto in corso di meningiti, in particolare con l’imipenem. Fattori favorenti: dosi elevate, insufficienza
renale, anziani, precedenti neuropsichiatrici, etilismo. Le sovrainfezioni nel corso del trattamento riguardano soprattutto gli stafilococchi meti-R, l’Enterococco, lo Pseu-domonas il Clostridium difficile, i Miceti (Candida). Per quanto riguarda l’associazione imipenem/cilastatina è stato dimostrato che la cilastatina è in grado di ridurre la nefrotossicità di diversi farmaci, inibendone la captazione e l’accumulo intracellulare. Uno studio condotto sui ratti ha dimostrato che la somministrazione di cilastatina è in grado di prevenire la sofferenza renale indotta dalla somministrazione di alte dosi di farmaci nefrotossici. Ma ancor più interessante è la sperimentazione condotta su pazienti sottoposti a trapianto di cuore e trattati con ciclosporina che, com’è noto, può indurre episodi di nefrotossicità legati ad alterazioni del tubulo renale. Tutti i pazienti erano trattati con ciclosporina, azatioprina e prednisone. Nei pazienti appartenenti al gruppo trattato è stata somministrata l’associazione imipenem/cilastatina 6 ore prima e 6 ore dopo l’inetervento, e nei successivi 7 giorni. Lo studio della curva della creatininemia ha dimostrato che i pazienti che hanno ricevuto la cilastatina non hanno presentato il rialzo della creatininemia, osservato invece nei pazienti del gruppo di controllo; inoltre, nel gruppo di controllo è stato necessario ricorrere nel 33% dei pazienti ad emofiltrazione o emodialisi, mentre nessuno dei pazienti che ha ricevuto la cilastatina ha necessitato di queste procedure. Risultati simili sono stati ottenuti anche in pazienti sottoposti a trapianto di rene. È evidente, quindi, che la cilastatina, necessaria per il corretto impiego dell’imipenem, può svolgere anche un’importante funzione accessoria ma non secondaria, riducendone la nefrotossicità.
Indicazioni cliniche
I carbapenemi sono riservati al trattamento delle infezioni severe da germi difficili o multiresistenti:-trattamento di attacco, fino all’isolamento del germe;-trattamento delle infezioni severe nei soggetti a rischio: neutropenici, soggetti di rianimazione, trattamenti
con citostatici e corticosteroidi, infezioni da Acinetobacter; -trattamento delle infezioni miste aerobie-anaerobie, addominali e pelviche; -trattamento di germi divenuti resistenti alle cef 3: Pseudomonas aeruginosa, Acinetobacter, Enterobacter,
Citrobacter, Serratia, Morganella, Klebsiella secretore delle beta-lattamasi ad ampio spettro, e dei germi in-sensibili alle cef 3: Listeria, Nocardia. Nell’insieme i carbapenemi sono utilizzati più spesso in monoterapia. La biterapia è utilizzata soprattutto per lo Pseudomonas (+ aminoside), Acinetobacter (+ sulbactam), enterococco (+ glicopeptide), staf. meti-R.
L’utilizzazione dei carbapenemi in prima o seconda istanza è in
funzione di molti fattori.
I fattori che depongono a favore di un trattamento in prima istanza con
carbapenemi sono: germi poco sensibili
o resistenti alle altre beta-lattamine, infezioni nosocomiali, neutropenia.Tutti gli streptococchi sono molto sensibili all’imipenem; la molecola risulta attiva anche contro gli enterococchi,a differenza del meropenem che presenta una ridotta attività nei confronti di Enterococcus faecalis ed Enterococcus
linquefaciens e non è attivo verso Enterococcus faecium. In Italia gli enterococchi vengono isolati nel 7-8% delle infezioni ospedaliere e tra essi il 95% è rappresentato dall’E. faecalis (costituiscono il 24% dei gram positivi isolati). Inoltre, per quanto riguarda gli anaerobi, l’imipenem presenta una maggiore attività antibatterica rispetto al meropenem e in particolar modo nei confronti dell’Actinomyces spp che è particolarmente sensibile all’imipenem ma completamente resistente al meropenem.
Controindicazioni
Ipersensibilità alle beta-lattamine.
Precauzione di impiego: prudenza nei soggetti con colite ed in caso di
precedenti convulsioni. Sorvegliare lo stato
neuropsichico nei soggetti a rischio. Ridurre la posologia giornaliera
in caso di insufficienza renale.
Interazioni farmacologiche
Interazioni utili (Tabella 3.26)Grazie al loro spettro antibatterico molto largo i carbapenemi sono utilizzati generalmente in monoterapia. Leassociazioni con altri agenti antinfettivi sono utilizzate solo per i germi difficili, poco sensibili con MIC più alte:Pseudomonas, Acinetobacter, Staf. meti-R, Enterococchi, Enterobatteri iperproduttori di cefalosporinasi di beta-lattamasi a spettro allargato o per evitare e trattare le sovrainfezioni in corso di terapia a causa di germi divenutiresistenti. Da ricordare per l’Acinetobacter l’associazione carbapenem-sulbactam per l’attività antibatterica propriadel sulbactam su questo germe.
Interazioni da evitare (Tabella 3.27)Non sono numerose e riguardano:-le associazioni dei carbapenemi, potenti induttori di beta-lattamasi, con le beta-lattamine idrolizzate dalle beta-
lattamasi indotte: carbossi- e dureidopenicilline, cef 3 e 4, aztreonam, penicilline antistafilococciche; -la neurotossicità di certi carbapenemi e la loro associazione con altri antinfettivi o altri medicamenti neurotossici, soprattutto in presenza di fattori favorenti.
Modalità di somministrazione e posologia
Imipenem + cilastatina sodica: la maggior parte delle infezioni risponde ad un dosaggio giornaliero di 1-2 g suddivisi in 3-4 somministrazioni (vedere successiva tabella).
Somministrazione per infusione endovenosa
| Dose (mg di | Intervalli di | Dosaggio | |
|---|---|---|---|
| Gravità della infezione | imipenem) | sommin. | giorn. tot. |
| Lieve | 250 mg | 6 ore | 1.0 g |
| Moderata | 500 mg | 8 ore | 1.5 g |
| 1000 mg | 12 ore | 2.0 g | |
| Grave- completamente sensibile | 500 mg | 6 ore | 2.0 g |
| Grave e/o pericolosa per la vita | 1000 mg | 8 ore | 3.0 g |
| - dovuta a microorganismi meno | |||
| sensibili (principalmente alcuni ceppi di | 1000 mg | 6 ore | 4.0 g |
| Pseudomonas aeuriginosa) | |||
Per l’elevata attività antimicrobica, si raccomanda che il dosaggio massimo giornaliero non superi i 50 mg/kg/die; comunque, qualunque sia il peso del paziente, non si devono superare i 4 g/die. Dosaggio negli adulti - Profilassi: per la profilassi delle infezioni post-operatorie negli adulti, si devono somministrare per via endovenosa 1000 mg al momento dell’induzione dell’anestesia e 1000 mg 3 ore più tardi. Nel caso di interventi a rischio elevato (come ad es. la chirurgia del colon-retto) si possono somministrare due dosi aggiuntive da 500 mg, 8 e 16 ore dopo l’induzione. Dosaggio pediatrico: per i bambini si raccomanda il seguente schema posologico: a) bambini con peso corporeo ≥ 40 kg devono ricevere la posologia per adulti; b) bambini con peso corporeo < 40 kg devono ricevere 60 mg/kg/die da suddividere in 4 dosi uguali somministrate ad intervalli di 6 ore. il dosaggio giornaliero complessivo non deve superare i 2 g. I dati clinici non sono sufficienti, per raccomandare l’uso di imipenem/cilastatina nei bambini di età inferiore ai 3 mesi ed in quelli con funzione renale compromessa (creatinina sierica > 2 mg/dl). Somministrazione intramuscolare: La formulazione intramuscolare di imipenem/cilastatina può essere usata in alter-nativa alla formulazione per infusione endovenosa nel trattaemnto di quelle infezioni per le quali è appropriata la terapia intramuscolare. In base alla severità dell’infezione, alla sensibilità del patogeno ed alle condizioni del paziente, si raccomanda un dosaggio totale giornaliero di 1 g o 1,5 g diviso rispettivamente in 2 o 3 somministrazioni. Meropenem: 1 g ogni 8 ore; 500 mg ogni 8 ore; anziani 500 mg ogni 12 ore.
Penemi
I penemi sono attualmente in una fase di studio preliminare, molto meno avanzata che per i carbapenemi; nessun
prodotto è attualmente commercializzato ma molti derivati sono in via di realizzazione.
Il loro sviluppo è frenato da molti fattori:
-emivita molto breve: 30-50 minuti;
-idrolizzati dalle deidropeptidasi renali e caratterizzati da un’intensa biotrasformazione metabolica.
I penemi hanno in comune con i carbapenemi le seguenti caratteristiche:
-uno spettro antibatterico molto ampio, quasi identico, ad eccezione che sullo Pseudomonas aeruginosa, resistente ai penemi;
-la grande stabilità a tutte le beta-lattamasi, grazie alla catena 1-idrossietile, comune alle due classi;
-la sensibilità alle deidropeptidasi renali con potere inattivante;
-il legame preferenziale sulle PBP 2 ed 1a.
I penemi si distinguono dai carbapenemi:
-per la possibilità di essere somministrati per via orale e per via parenterale;
-per l’assenza di attività sullo Pseudomonas.
3.5 MONOBATTAMI
Generalità
I monobattami costituiscono il gruppo più recente, ancora in piena evoluzione, delle beta-lattamine. Per ora solo un composto viene utilizzato in clinica: l’aztreonam (Figura 3.15), ma molti altri stanno per essere sviluppati: oxizonam e pirazmonam a somministrazione parenterale (come i precedenti), gloximonam e tigemonam, a somministrazione orale. I monobattami presentano molte caratteristiche comuni: -uno spettro antibatterico ristretto, limitato ai bacilli aerobi Gram negativi e con l’esclusione degli anaerobi Gram
negativi; -la produzione per sintesi chimica totale; -l’assenza di fenomeni allergici di tipo immediato delle beta-lattamine, IgE mediati.
Composizione chimica ed origine
I monobattami presentano una struttura di base monociclica, rappresentata dall’acido 3-amminobattamico (3-ABA), senza un anello tiazolidinico (penicilline) o diidrotiazinico (cefalosporine).Inizialmente essi furono ottenuti per fermentazione di alcuni batteri: Pseudomonas acidophila, Chromobacteriumviolaceum, ma attualmente sono prodotti per sintesi chimica.Nella loro struttura chimica si riscontra:-un gruppo N-sulfonico (monosolfattami) responsabile dell’attivazione del nucleo beta-lattamico e dell’azione
anti-Pseudomonas; -un gruppo metilico su C2 che assicura la resistenza all’idrolisi da parte delle beta-lattamasi batteriche; -una sostituzione aminotiazol-metossi-iminica, come nelle cefalosporine di terza generazione.
![]() S
S
H CH3 C CONH
H +H3C N N
![]() CH3
CH3
O![]()
C CO2H SO3
CH3
Figura 3.15 Struttura chimica dell’aztreonam.
L’esterificazione su N nel nucleo beta-lattamico porta alla sintesi di composti a somministrazione orale, caratteriz-zata dall’assorbimento per via gastroenterica: esempio gloximonam è l’estere ter-butossiglicolato dell’oximonam, monobattamico a somministrazione parenterale.
Proprietà fisico-chimiche
Basso peso molecolare, idrofilia. L’ aztreonam è somministrato con l’arginina al fine di assicurare una migliore solubilità, stabilità e tolleranza locale, per effetto tampone (pH intorno a 5).
Meccanismo d’azione
Azione battericida per fissazione elettiva sulla PBP 3, con conseguente formazione di forme batteriche filamentose, come si verifica con le cefalosporine. Azione di inibizione delle beta-lattamasi cromosomiche e notevolissima resistenza all’idrolisi da parte di tutte le beta-lattamasi, cromosomiche e plasmidiche, comprese le cefalosporinasi inducibili, ad eccezione delle beta-lattamasi a largo spettro (cefotaximasi plasmidiche delle Klebsielle). Non, o molto debole, induzione delle beta-lattamasi, debole effetto inoculo. Spesso azione sinergica con gli aminosidi sullo Pseudomonas aeruginosa ed enterobatteri multire-sistenti.
Spettro d’azione e resistenza batterica
Spettro antibatterico ristretto, limitato ai bacilli Gram negativi e comprendente lo pseudomonas, ad eccezione dei bacteroidi: tutti gli enterobatteri, H. influenzae, Neisseria, Branhamella, Yersinia (germi molto sensibili con MIC
< 0.5 µg/ml, equivalenti a quelle delle cefalosporine di terza generazione), Aeromonas, Shigella, Salmonella, Pasteurella, Pseudomonas aeruginosa (MIC < 12 µg/ml equivalente a quella della ceftazidima). Tuttavia, i monobattami a somministrazione orale (gloximonam, tigemonam) hanno perso l’attività su Pseudomonas ed Acinetobacter. Ger-mi spesso resistenti (MIC > 32 µg/ml): Acinetobacter, Bordetella, Moraxella. Germi resistenti: Flavobacterium, Alcaligenes, Pseudomonas maltophilia e cepacia, tutti gli anaerobi Gram positivi e Gram negativi, tutti i germi (cocchi e bacilli) Gram positivi; Citrobacter, Enterobacter e Serratia hanno una sensibilità variabile, con una larga gamma MIC: i ceppi iperproduttori di cefalosporinasi o di beta-lattamasi a largo spettro sono resistenti. Il pirazmonam si distingue dagli altri monobattami per un’attività molto intensa su Pseudomonas-Acinetobacter (più attivo della ceftazidima): MIC < 1 µg/ml. Per gli enterobatteri si ha spesso una resistenza crocia-ta tra monobattamici e oxi-imino-cefalosporinasi.
Farmacocinetica
Farmacocinetica lineare, dose dipendente Aztreonam, carumonam: -assorbimento gastroenterico: quasi nullo (<1%), 30% per gloximonam per via orale. -picchi sierici: iv (1 g e 2 g): aztreonam 125 e 240 µg/ml, carumonam 78 e 150 µg/ml -im (1g ) aztreonam 45 mcg/ml. Via orale (gloximonam 250 mg): 10 mcg/ml -emivita plasmatica 1.6-2 h per entrambi -AUC (1 g): aztreonam 270 -% di legame alle proteine plasmatiche: aztreonam 55%, carumonam 18%, tigemonam 62% -Biotrasformazione metabolica Aztreonam: molto scarso (15%): metabolita formatosi per apertura del nucleo beta-lattamico che ha un’emivita molto più lunga (20 ore) rispetto al prodotto non metabolizzato; 87% è eliminato sotto forma non metabolizzata. -Volume di distribuzione (l/kg): 0.18. Relativamente buona la diffusione nel liquido cefalorachidiano (tasso di 4
µg/ml) e nel tessuto osseo. Molto scarso il passaggio nel latte materno. -escrezione e concentrazione biliare: tassi biliari 20-45 µg/ml. Eliminazione fecale: 12% per l’aztreonam, 3% per
il carunoman. -Eliminazione urinaria: 70% per entrambi. L’aztreonam è eliminata per filtrazione glomerulare e per secrezione tubulare (bloccata dal probenecid), il carumonam
è eliminato solo per filtrazione glomerulare. -Clearance totale (ml/min): aztreonam 90-100 (1.3-1.5 ml/min/kg), carumonam 150 -clearance renale (ml/min): aztreonam 60, carumonam 115-120 -Picchi urinari molto alti: 1500-3500 µg/ml (aztreonam), 500 µg/ml carumonam -Dializzabili (30-60%).
Tossicità ed effetti indesiderati
Sono in comune con quelli delle altre beta-lattamine: disturbi gastroenterici (ma più rari che con le beta-lattamine ad ampio spettro, fatto legato al rispetto della flora anaerobica), aumento transitorio e reversibile delle transamina-si e della fosfatasi alcalina, eruzioni cutanee allergiche ed eosinofilia (tuttavia, i monobattami non sembrano pro-vocare reazioni allergiche immediate di tipo I mediate dalle IgE, come per le altre beta-lattamine) . L’equilibrio ionico non è turbato dall’ aztreonam, perché questo non contiene sodio e la tolleranza locale per via intramuscolare è migliore e non necessita di essere somministrato insieme ad un anestetico locale. Per contro, sono possibili delle sovrainfezioni e colonizzazioni batteriche da enterococco e da stafilococco in corso di trattamento, perciò è necessaria l’associazione profilattica o terapeutica con vancomicina-teicoplamina.
Indicazioni cliniche
Trattamento ospedaliero delle infezioni severe da enterobatteri e da Pseudomonas aeruginosa: setticemie da bacilli Gram negativi soprattutto in pazienti neutropenici, con l’esclusione di meningiti, mucoviscidosi e pneumopatie nosocomiali da bacilli Gram negativi, infezioni urinarie nosocomiali complicate, infezioni addominali e ginecologi-che (in associazione con un nitroimidazolo), infezioni osteoarticolari da bacilli Gram negativi, salmonellosi, infezio-ni cutanee, gonorrea. L’aztreonam, associato ad altri antibiotici, potrebbe rimpiazzare gli aminoglicosidi, soprattut-to in caso di insufficienza renale. Un’altra indicazione è costituita dal trattamento delle infezioni in soggetti allergici ad altre beta-lattamine (ma occorre grande prudenza!). Per via orale (100 mg x 3) aztreonam è consigliato per il trattamento di infezioni enteriche e per la decontaminazione del tubo digerente nei soggetti a rischio.
Controindicazioni
Allergia ai monobattami
Precauzioni di impiego
In caso di insufficienza renale, la posologia giornaliera dovrà
essere ridotta ed adattata al grado di funzione renale
residua.
In caso di insufficienza epatica, sorveglianza biologica.
Interazioni farmacologiche
Interazioni utili(soprattutto al fine di allargare lo spettro d’azione antibatterica) (Tabella 3.28).-con gli anti-anaerobi (clindamicina, nitroimidazoli): trattamento delle infezioni miste aerobi-anaerobi;-con la polimixina-colistina: Enterobatteri, Pseudomonas;-con la vancomicina-teicoplanina: trattamento delle sovrainfezioni da enterococco o da stafilococco;-con le penicilline antistafilococciche;-con gli aminosidi: Pseudomonas, enterobatteri;-con la piperacillina: Pseudomonas, enterobatteri;
-con le cefalosporine anti-Pseudomonas: ceftazidima, cefsulodina, cefoperazone, cef 4;-con il probenecid.Interazioni da evitare-con le beta-lattamine potenti induttori di beta-lattamasi: antagonismo per induzione delle beta-lattamasi (Ente-
robacter, Pseudomonas aeruginosa);
Incompatibilità fisico-chimica: con il metronidazolo per via iv, naftacilina iv.
Modalità di somministrazione e posologia
Aztreonam: fiale da 500-1000 mg.Posologia: 1-2 g/die (infezioni urinarie) nel trattamento delle infezioni severe sistemiche 1-2 g ogni 8-12 h; neonatie bambini nella prima infanzia 30 mg/kg iv ogni 6-8 ore; bambini oltre i due anni 30 mg/kg iv o im ogni 6 ore.
| Potenti induttori delle beta-lattamasi | |||
|---|---|---|---|
| (cefalosporinasi cromosomiche di classe I) | Deboli induttori delle beta-lattamasi | ||
| Beta-lattamine labili | Beta-lattamine stabili | Carbossipenicilline | |
| alle beta-lattamasi | alle beta-lattamasi | Ureidopenicilline | |
| Penicilline anti-stafilococciche | |||
| Penicillina G | Cefamicina | Cefalosporine di III generazione | |
| Aminopenicillina | Latamoxef | Monobattami | |
| Cefalosporine di I | Imipenem | Sulbactam, tazobactam | |
| e II generazione | Acido clavulanico | ||
N. di molecole di PBP Conseguenze
Peso per cellula Attività Affinità selettive della inibizione PBP molecolare batterica enzimatica per le β-lattamine delle PBP
1-A 92000 230 1-B 90000
2 66000 20
3 60000 50
4 49000
![]() 0 5
42000 1800 6 40000 570
0 5
42000 1800 6 40000 570
Transpeptidasi, transglicosilasi implicata nel processo di allungamento cellulare
Transpeptidasi e possibile transglicosilasi che permette l’introduzione del peptido-glicano nel nuovo sito di crescita della parete
Transglicosidasi transpeptidasi implicata nella formazione del setto della divisione cellulare
D-alanina-carbossipeptidasi
D-alanina-carbossipeptidasi
D-alanina-carbossipeptidasi Benzilpenicillina Cefaloridina Amoxicillina
Mecillinam (Acido clavulanico) Imipenem
Ampicillina Piperacillina Cefalosporine Moxalactam Sferoplasti e lisi cellulare rapida
Cellule globulari stabili in mezzo iso-osmotico
Forme filamentose senza setto
Assenza di anomalie morfologiche cellulari
Assenza di anomalie morfologiche cellulari
Assenza di anomalie morfologiche cellulari
Gram-positivi Gram-negativi Penicillinasi
| S. aureus S. epidermidis E. faecalis CROMOSOMICHE | PLASMIDICHE | |||||
|---|---|---|---|---|---|---|
| Cefalosporinasi (I) | Cefuroximasi (I) | Ampio spettro | (II) Penicillinasi AD (IV) Ampio spettro | Penicillinasi (ampio spettro) | Ampio spettro (non inducibile) | |
| P. vulgaris | Bacteroides | Klebisella | (III) TEM-I, TEM-2 | TEM-3 (CTX-1) |
| P. penneri | Branhamella | OXA-1,2,3 | TEM-4 | |
| Ps. cepacia | Valiversus (Levinea) | (V) PSE-1,2,3,4 | SHV - 2 - 6 | |
| SHV, HMS-1 |
| Inducibile | Costitutivo | ||
|---|---|---|---|
| Enterobacter | Acinetobacter | ||
| Citrobacter | |||
| Serratia | |||
| Pseudomonas | |||
| Providencia | |||
| Attività degli inibitori delle β-lattamasi | (I-V) Classificazione modificata da Richmond e Sykes | ||
| Le sigle CTX, HMS, OXA, SHV, PSE, TEM indicano i differenti tipi enzimatici delle β-lattamasi | |||
BETA-LATTAMINE
| β-lattamasi | Localizzazione genetica | Substrati preferentiPenicilline Cefalosporine | Inducibile I | Costitutiva C Germi produttori | Sensibilità antibatterica Sensibili Resistenti (inibiti) (non inibiti) P.M. | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Classe I Cromosomica Cefalosporinasi indotta o mutanti depressi stabili o iperproduttori | ++++ | I | Enterobacter, citrobacter, Serratia, Proteus indole +, Pseudomonas, Acinetobacter | Clox, Carb, aztreonax | p C M B Clav Sulb | 20-42 | |||||
| Classe II Penicillinasi | Cromosomica | ++ Amino- ei carboxipen | – | I | C | E.coli, Klebsiella, Pseudomonas, Proteus mirabilis, Vibrio parahenolyaticus, Branhamella | Clox, Carb, Sulb | p C M B Carb | 32 | ||
| Classe III A largo spettro (più frequenti) | Plasmidi transposoni (TEM 1-6, SHV-1 SHV-2, CTX-1) | +++ | +++ | – | C | TEM: enterobacteries, Neisseria, H. influenzae, Brahnamella, Pseudomo-nas. SHV: Klebsiella | Clox, Clav | p C M B | 23 | ||
| Classe IV A largo spettro | Cromosomica | +++ | ++ | – | C | Klebsiella, Enterobacter | Clav, Sulb | p C M B Clox Carb | 14-24 | ||
| Classe V Penicillinasi, oxacillinasi, carbenicillinasi | Plasmidi transposoni OXA 1-7, PSE 1-4 | ++ Amino-ei carboxipen oxacillina | – | – | C | OXA: E.coli, Pseudomonas PSE: Ps.aeruginosa | Clav, Sulb | p C M B cloxacilline | OXA 23-43 PSE 12-32 | ||
| Classe VI Cefalosporinasi (bacteroides) | Cromosomica | + | +++ | – | C | Bacteroides | Carb, Clav Sulb | Clox Gefoxitine | 26-32 | ||
Clox = Cloxacillina Carb = Carbenicillina Clav = Acido clavulanico Sulb = Sulbactam p C M B = P. Cloromercuribenzoato
128 VADEMECUM DEGLI ANTIBIOTICI
Classe A • Beta-lattamasi plasmicidiche: TEM-1, TEM-2, SHV1 (beta-lattamasi inibite dagli • Carbenicillinasi specifiche dello Pseudomonas inibitori delle beta-lattamine) • Penicillinasi stafilococciche (cromosomiche)
• Beta-lattamasi a largo spettro antibatterico Classe B • Beta-lattamasi che idrolizzano i penemi ed i carbapenemi Classe C • Cefalosporinasi cromosomica (inducibili) Classe D • Oxacillinasi di batteri Gram negativi
| Penicilline (DCI) | Forme farmaceutiche | Posologie |
|---|---|---|
| Oxacillina | Fiale i.m., ev da 1 g | A: i.m., ev fino a 2 g/die B: 25-50 mg/kg/die |
| Cloxacillina | Perle 500 mg FI da 1000 mg i.m. | A: 2-3 g/j iv 3-4 somministrazioni B: 25-50 mg/kg/j e fino a 100 mg/kg/j |
| FI da 1000 mg iv (diluita in glucosata isotonica) | A: 50-100 mg/kg/j e fino a 200 mg/kg/j | |
| Flucloxacillina | Fiale IM e compresse da 1 g 100 mg/kg/die in dosi refratte | A: 1 cpr ogni 6-8 ore; 1 f. ogni 8 ore B: 1/2 cpr ogni 8 ore, per via i.m. fino a |
D.C.I. Assorbimento Picco sierico Emivita (h.) Legame Metaboliti
gastroenterico(µg/ml) proteico % %
Penicillina G sodica o potassica
Penicillina V
(1.000.000U.I.)
(500 e 1.OOO mg)
Cloxacillina
(500 e 1.000 mg)
Dicloxacillina
(500 mg)
Nafcillina
Ampicillina
(500-1.000 mg)
(200 e 400 mg)
Acido clavulanico
Sulbactam IV
1500 mg
Sultamicillina
750 mg p.o.
– 20-30 U.I. (1.000.000 U.I.) 300-400 U.I. (5.000.000 U.I.) 600-700 U.I. (10.000.000 U.I.)
++ 4-6 U.I. (1.000.000 U.I.) (60%)
- +
- P.O.: 500 mg 4-15; 1.000 mg 8-1 IM: 500 mg 8-11 IV: 1.000 mg 50-80
- +
- P.O. 500 mg: 6-10; 1.000 mg: 18 IM: 1.000 mg: 20-25 IV: 1.000 mg: 50-80
- +
- P.O.: 15-20
- +
- 10
- +
- P.O.: 500 mg 3-4;
1.000 mg: 7-8 I.M.: 1.000 mg 15-1
IV: 50 µg
+++ P.O.: P.O.: 500 mg 7-10;
1.000 mg 15-18 IM: 1.000 mg 22 IV: 1.000 mg 180
+++ P.O.: 200 mg: 3-4; 400 mg: 5
IV: mecillinam 10 mg/kg: 60 µg/ml IM: 25 µg/ml
++ P.O.: 125 mg: 3-5
IV: 200 mg: 10-1 (perfusione)
– IV: 30
++ P.O.: 8-9 15-25
| 0.5 | 40-65 |
|---|---|
| 1 | 55 |
| O.5-1 | 90 |
| 0.6 | 94 |
| 0.7-1 | 95 |
| 0.5-1 | 90 |
| 1 | 18-20 |
| 1-1.5 | 17 |
| 1 | 5-10 |
| 1 | 22 |
| 1 | 20-25 |
| 1 | 35-40 |
30-50 45
15
15 50-60 <10
<20
20
0
<20 <20
| V.D. (l/kg) | Clearance (ml/min) Totale Renale | Tassi urinari medi (µg/ml) | % escrezione urinaria 24 h. | % elimi-nazione biliare | Diffusione | L.C.R. Tasso | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 0.35 | 450-500 | 350-380 | 200-800 | 60-90 (G+T) | 0.10 | + | 5-10 U.I. (20.000.000 U.I.) | |||
| 0.35 | 450-500 | 150 | 100-400 | 30-40 | 1-3 | – | – | |||
| 0.12 | 250-300 | 120-150 | P.O. 600-1000 IM,IV 2000 P.O. 30 IM, IV 55 (G+T) | ± | ||||||
| 0.10 | 150-180 | 100-120 | 600-2000 | P.O. 50 IM, IV 70-80 (G+T) | 20-30 | ± | ||||
| 0.10 | 100-120 | 60-70 | 1000-2500 | 70-80 (G+T) | ± | |||||
| 0.15 | 160 | P.O. 20 IV 40 | 80 | |||||||
| 0.20 | 300-320 | 260 | P.O. 500 IV 1500-2000 P.O. 30-40 IV 70-80 (G+T) | 20 (etampicillina IV ) | ++ | 2-8 UI (IV) | ||||
| 0.30 | 310-370 | 250-300 | 1500-1800 | 70-80 (G+T) | 5-10 | ++ | 2-10 UI (IV) | |||
| 0.25 | 400-500 | 200-300 | 70-180 | 45-50 (G+T) | ++ | – | ||||
| 0.30 | P.O. 200-300 IV 120-180 | P.O. 90-140 I.V. 80 | P.O. = <150 IV 150400 | P.O. 45 IV 50-60 (G) | – | – | – | |||
| 0.25-0.30 | 150-200 | >300 | G+T | 15-20 | – | ± | ||||
| 0.25-0.30 | 150-200 | >300 | G+T | 15-20 | – | ± | ||||
(continua) (continua)
| D.C.I. | Assorbimento | Picco sierico | Emivita | Legame | Metaboliti |
| gastroenterico | (µg/ml) | (h.) | proteico | % | |
| % |
| Tazobactam | – | IV bolo: 18 | 1 | 20-25 | <20 |
| 500 mg i.v. | IV perfusione: 33 | ||||
| Carbenicillina | – | Perfusione IV | 1-1.1 | 45 | <5 |
| (5 e 10 g) | 5 g: 150-250 | ||||
| 10 g: 300-500 | |||||
| Ticarcillina | – | Perfusione IV | 1.2 | 45 | <5 |
| (2 e 5 g) | 2 g: 110; 5 g: 250-300 | ||||
| Mezlocillina | – | Perfusione IV | 0.8-1 | 30 | <10 |
| (5 g) | 5 g: 400-450 | ||||
| Azlocillina | – | Perfusione IV | 0.8-1 | 30-35 | <10 |
| (5 g) | 5 g: 400-450 | ||||
| Piperacillina | – | Perfusione IV | 1-1.1 | 16-20 | <5 |
| (4 g) | 4 g: 250 | ||||
| Temocillina | – | IV: 160-170 | 5 | 85 | |
| (1 g) |
| V.D. | Clearance (ml/mn) | Tassi urinari | % | % | L.C.R. | ||||
|---|---|---|---|---|---|---|---|---|---|
| (l/kg) | medi | escrezione | elimi- | ||||||
| Totale | Renale | (µg/ml) | urinaria 24 h. | nazione biliare | Diffusione | Tasso | |||
| 0.25-0.30 | 200-250 | >300 | 60-80 | 15-20 | – | ± | |||
| (mai 135 in | (G+T) | ||||||||
| assoc. con | |||||||||
| piperacillina) | |||||||||
| 0.20 | 130 | 130 | 5000-10.000 | 90 | ±0.2 | + | 15 | ||
| 0.22 | 130 | 120-130 | 2000-5000 | 80 | ± | + | 15-20 | ||
| (G+T) | |||||||||
| 0.35 | 400-500 | 220-300 | 1500-7000 | 55 | ++20-30 | ++ | 7-12 | ||
| (G+T) | |||||||||
| 0.22 | 200-250 | 120-180 | 1000-6000 | 60-70 | ++20-30 | ++ | 3-15 | ||
| (G+T) | |||||||||
| 0.30 | 250-350 | 150-300 | >1000 | 70 | ++20-30 | ++ | 9-20 | ||
| (G+T) | (G+T) | ||||||||
| 0.20 | 19-22 | 450-1000 | 80-90 | +++ | |||||
| Altro anti-infettivo o | Germi interessati o |
| altro medicamento | Effetto ottenuto Meccanismo indicazioni principali |
| Cefalosporine 3a | Sinergia+ ampliamento dello Copertura dei 3 germi Streptococchi B Listeria, |
| generazione | spettro d’azione (enterococchi, responsabili delle meningiti enterobatteri (meningiti ) |
| streptococco B, Listeria) neonatali Klebsiella (produttrice di | |
| Enterobatteri produttori β-lattamasi ad ampio spettro) | |
| di β-lattamasi ad ampio | |
| spettro (Klebsiella) | |
| Pivmecillinam | Sinergia antibatterica+ Azione complementare su PBP Enterobatteri |
| inibizione della resistenza differenti: PBP1 e 3- Ampicillina Salmonella | |
| batterica PBP2- Pivmecillinam | |
| Cloramfenicolo | Inibizione delle β-lattamasi Inibizione della sintesi della Meningite da H. influenzae |
| ad opera del cloramfenicolo+ della parete batterica Ascesso cerebrale (anaerobi) | |
| diffusione intracerebrale (aminopenicilline) Salmonelle | |
| Inibizione della sintesi | |
| delle proteine batteriche | |
| (cloramfenicolo) | |
| Claritromicina | Effetto sinergico Inibizione della sintesi della Trattamento di eradicazione di |
| Roxitromicina | parete (aminopenicilline) H. pylori (ulcere digestive in |
| Inibizione della sintesi delle associazione con un inibitore | |
| proteine (macrolidi) della pompa protonica | |
| Trattamento delle infezioni | |
| respiratorie da agenti batterici | |
| Cotrimossazolo | Sinergia antibatterica Azione battericida congiunta Meningoencefalite da Listeria |
| su bersagli batterici diversi | |
| Dalfopristina+ | Effetto battericida aumentato+ Azione su bersagli batterici Pneumococchi a sensibilità |
| Chinopristina | inibizione delle resistenze differenti: parete batterica diminuita alla penicillina |
| (streptogramine) | batteriche (aminopenicilline), sintesi |
| delle proteine batteriche Enterococchi | |
| (streptogramine) | |
| Nitroimidazolo | Effetto antibatterico sinergico+ Azione battericida conservata Eradicazione di H. pylori |
| azione conservata nell’ambiente a tutti i pH (nitroimidazolo), in (ulcere digestive, gastrite | |
| acido dello stomaco+ associazione con un inibitore cronica) | |
| inibizione delle resistenze della pompa protonica+inibizione | |
| batteriche delle resistenze batteriche | |
| Inibitori delle | Recupero della sensibilità di Inibizione irreversibile delle Germi produttori di β-lattamasi: |
| beta- lattamasi: | ceppi batterici produttori di β- lattamasi enterobatteri (compresa la |
| acido clavulanico, | β-lattamasi, degli Klebsiella produttrice di |
| sulbactam, tazobactam | enterobatteri, degli stafilococchi β-lattamasi ad ampio spettro), |
| e degli anaerobi stafilococchi, anaerobi | |
| Fosfomicina | Azione sinergica o additiva+ Azione congiunta e sequenziale Enterobatteri |
| inibizione delle resistenze sulla sintesi della parete batterica Enterococchi | |
| batteriche Aumento dell’attività battericida Enterococchi ed anaerobi | |
| Glicopeptidi: | Ampliamento dello spettro Azione congiunta e sequenziale |
| vancomicina, | antibatterico (anaerobi,stafilosulla sintesi della parete batterica |
| teicoplanina | cocchi meticillino- resistenti) |
| Rifampicina | Effetto additivo+ inibizione delle Azione su bersagli batterici Enterococchi |
| resistenze batteriche differenti: parete batterica | |
| (aminopenicilline), Listeria | |
| RNA batterico (rifampicina) | |
| Probenecid | Aumento dei tassi ematici e del Competizione sulla secrezione Trattamento delle gonococcie |
| LCR, aumento della emivita delle tubulare delle aminopenicilline Trattamento delle endocarditi e | |
| β-lattamine delle meningiti batteriche |
Altri antiinfettivi Patogeni coinvolti Penicilline o altri o indicazioni antistafilococciche medicamenti Effetto ottenuto Meccanismo principali
Oxacillina Acido fusidico Sinergia antibatterica+ Azione su bersagli batterici Stafilococchi meticillino-Cloxacillina inibizione delle differenti: inibizione della sensibili e meticillino- Flucloxacillina resistenze batteriche sintesi della parete batterica resistenti
(penicilline), inibizione della sintesi delle proteine batteriche (acido fusidico)
Aminoglicosidi Sinergia antibatterica+ Azione su bersagli batterici Stafilococchi meticillino-antistafilococcici: inibizione delle resistenze differenti: inibizione della sensibili e meticillino-arbekacina, ecc antibatteriche+ aumento sintesi della parete batterica resistenti
dell’effetto battericida (penicilline), inibizione della sintesi dellle proteine batteriche (aminoglicosidi), aumento della permeabilità della parete batterica per l’aminoside da parte della penicillina
Fluorochinoloni Effetto additivo o Azione su bersagli batterici Stafilococchi meticillino-(soprattutto sinergico+ inibizione differenti: inibizione della sensibili e meticillino-ofloxacina, delle resistenze sintesi della parete batterica resistenti pefloxacina, batteriche+ aumento (penicilline), inibizione della sparfloxacina) dei tassi ematici per DNA- girasi (fluorochiniloni)
competizione sulla secrezione tubulare+ eliminazione dei plasmidi da parte dei fluorochinoloni
FosfomicinaSinergia antibatterica+ Inibizione sequenziale della Stafilococchi meticillino-inibizione delle sintesi della parete batterica, sensibili e meticillino-resistenze batteriche inibizione della PBP2a degli resistenti
stafilococchi meticillinoresistenti ad opera della fosfomicina
Glicopeptidi: Sinergia antibatterica+ Inibizione sequenziale della Stafilococchi meticillino-teicoplanina, inibizione delle sintesi della parete batterica, sensibili e meticillino-vancomicina resistenze batteriche aumento dell’effetto resistenti
battericida
RifampicinaSinergia antibatterica+ Azione su bersagli batterici Stafilococchi meticillino-inibizione dell eresistenze differenti: inibizione della sensibili e meticillino-batteriche, aumento sintesi della parete batterica resistenti dell’attività battericida (penicilline), inibizione
dell’RNA batterico
(rifampicina) Streptogramine: Effetto antibatterico Azione su bersagli batterici Stafilococchi meticillino-pristinamicina, additivo o sinergico+ differenti: inibizione della sensibili e meticillino-dalfopristina+ inibizione delle sintesi della parete batterica resistenti chinopristina, resistenze batteriche (penicilline), inibizione della virginiamicina sintesi delle proteine
batteriche (streptogramine)
Interleuchina 2 Profilassi delle Immunologico Stafilococchi, sovrainfezioni streptococchi stafilococciche favorite dall’interleuchina 2
Mezzi di prevenzione Comportamento Anti-infettivi Altri anti-infettivi Tipo di rischio Fattori favorenti Meccanismo o correzione da adottare
Penicillina G CloramfenicoloRischio soprattutto Immunodepressione Antagonismo tra Da evitare nei siti
Penicillina V Tetraciclinein alcune condizioni Patogeni a sensibilità antibiotici batteriostatici e con patogeni citati di difficile diffusione: diminuita ed antibiotici battericidi vegetazioni endocardiche (endocarditi), meningiti (pneumococco, Listeria)
Penicilline sodiche Fosfomicina sodicaRischio di sovradosaggio Dosi elevate Sovraccarico sodico Restrizione sodica Precauzione nell’uso
o disodiche, utilizzate sodico: edemi, aumento Cardiopatici Ipokaliemia Riduzione della posologia a dosi elevate: dell’ipertensione arteriosa Ipertesi nei soggetti a rischio carbossipenicilline Cirrotici ureidopenicilline Nefropatici
PenicillineGriseofulvina Aumento di rischio Origine comune Precauzione nell’uso Penicillamina allergico (Penicilium)
Penicilline deboli β-lattamine Rischio di fallimento Infezioni da estese Selezione da parte delle Associazione di un inibitore Sconsigliata induttrici di induttrici potenti terapeutico e di super-popolazioni batteriche β-lattamine induttrici delle β-lattamasi (per le β-lattamasi: delle β-lattamasi: infezioni nel corso del (eccesso di β-lattamasi) delle β-lattamasi dei β-lattamasi ad ampio spettro amdinocillina, aminopenicilline, trattamento ad opera di mutanti attivi iper-di Klebsiella,E. coli) carbossi- ed cefalosporine di 1a e germi resistenti produttori di β-lattamasi ureidopenicilline, 2a generazione, e di β-lattamasi a largo penicilline latamoxef, spettro, resistenti alle antistafilococciche, cefamicine, acido cefalosporine per taluni penicillinato-clavulanico, germi (Enterobacter,
VADEMECUM DEGLI ANTIBIOTICI
| Mezzi di prevenzione | Comportamento | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Anti-infettivi | Altri anti-infettivi Tipo di rischio | Fattori favorenti | Meccanismo | o correzione | da adottare | |||||||||
| sulfoni (Sulbactam, carbapenemici | Citrobacter, Acinetobacter, | |||||||||||||
| Tazobactam) | Serratia, Pseudomonas) | |||||||||||||
| Penicilline orali | Neomicina per os | Trattamento prolungato | Inibizione dell’assorbimento | Da utilizzare con cautela | ||||||||||
| (V, ecc) | con neomicina orale | digestivo delle penicilline | ||||||||||||
| da parte della neomicina | ||||||||||||||
| Penicilline | Acido fusidico | Rischio aumentato | Insufficienzaa epatica, | Aumento | Sorveglianza dei test di | Precauzione nell’uso | ||||||||
| antistafilococciche | di epatotossicità | etilismo | dell’epatotossicità | citolisi e colestasi | ||||||||||
| Penicilline orali | Accelerazione dello | Diminuzione della | Somministrazione | Accelerazione dello | Rispettare un intervallo di | Da usarsi con cautela | ||||||||
| ad assorbimento | svuotamento gastrico: | biodisponibilità orale | simultanea | svuotamento gastrico | più di 3 ore tra le due | |||||||||
| digestivo | metoclopramide, | delle penicilline | somministrazioni | |||||||||||
| incompleto | cisapride | |||||||||||||
| Penicilline | Soluzioni antibiotiche Aumentato rischio | Diatesi allergica | Effetto allergico | Precauzione nell’uso | ||||||||||
| contenenti sulfiti* | allergico | addizionale | ||||||||||||
* La maggior parte degli aminosidi, doxiciclina ev, clorochina im, chinina formiato ev, cotrimossazolo ev ed im, antimoniato di meglumina, rifocina im, rifampicina sospensione orale.
BETA-LATTAMINE
VADEMECUM DEGLI ANTIBIOTICI
| Altri antibiotici | Fattori | Mezzi di prevenzione | Comportamento | ||
| o altri farmaci | Tipo di rischio | favorenti | Meccanismo | o correzione | da adottare |
| Cloramfenicolo | Rischio di antagonismo | Basso dosaggio | Antagonismo tra antibiotici | Da evitare nelle meningiti | |
| Tetracicline | batterico in alcune | battericidi (aminopenicilline) | |||
| condizioni (meningite | e antibiotici batteriostatici | ||||
| o dove la loro diffusione | (cloramfenicolo, tetracicline) | ||||
| risulta difficile) | |||||
| Streptogramine | Effetto antagonista | Antagonismo per taluni germi | Antibiogramma dell’associazione | Da utilizzare con cautela | |
| (in vitro) | (E. faecalis) | ||||
| Griseofulvina | Rischio di allergie | Diatesi allergica | Origine simile (penicillium) | Sconsigliata | |
| Penicillamina | |||||
| Allopurinolo | Rischio di eruzioni | Mononucleosi | Sconsigliata | ||
| Tisopurina | cutanee | infettiva | |||
| Leucemia linfoide | |||||
| cronica | |||||
| Clorochina | Diminuzione | Assunzione | Rispettare un intervallo di 3 ore | Da utilizzare con cautela | |
| dell’assorbimento | simultanea | tra le due assunzioni | |||
| digestivo dell’ampicillina | |||||
| Metoclopramide | Aumento della motilità | Diminuzione | Accelerazione dello | Rispettare un intervallo di 3 ore | Da utilizzare con cautela |
| Cisapride | intestinale | dell’assorbimento | svuotamento gastrico | tra le due assunzioni | |
| Domperidone | digestivo | ||||
| dell’ampicillina |
| Altri antibiotici o | Mezzi di prevenzione | Comportamento | |
|---|---|---|---|
| Antibiotico | altri medicamenti Tipo di rischio | Fattori favorenti Meccanismo o correzione | da adottare |
| Amoxicillina+ | Cloramfenicolo Antagonismo antibatterico | Immunodepressione Antagonismo tra | Evitare il trattamento delle |
| acido clavulanico | Tetracicline a certi livelli (meningiti) | antibiotici battericidi | meningiti |
| (Co- amoxiclav) | e con certi germi | (amoxicillina) ed | |
| (pneumococchi e Listeria) | antibiotici batteriostatici | ||
| (tetracicline, | |||
| cloramfenicolo)+ tasso | |||
| insufficiente di acido | |||
| clavulanico nel LCR | |||
| Antiinfettivi che Rischio aumentato di | Dosi elevate Epatotossicità addizionale Monitoraggio dei test | Precauzione nell’uso | |
| presentano una certa epatotossicità | Trattamenti prolungati epatici: transaminasi, | ||
| epatotossicità: | Insufficienza epatica fosfatasi alcalina, | ||
| penicilline | adattamento della | ||
| antistafilococciche | posologia | ||
| (isossazolil- penicilline) | |||
| Acido fusidico, | |||
| Macrolidi Griseofulvina, | |||
| chetoconazolo | |||
| Antitubercolari: isoniazide | |||
| isoniazide, pirazinamide | |||
| Antimalarici: amodiachina, | |||
| alofantrina, meflochina | |||
| Antielmintici imidazolici: | |||
| albendazolo, tiabendazolo | |||
| Allopurinolo Tisopurina Rischio di eruzioni cutanee | Mononucleosi infettiva | Da evitare | |
| Leucemia linfoide cronica | |||
| Penicillamina Rischio aumentato | Somministrazione Allergia (stessa origine | Da evitare | |
| di allergie | sequenziale delle penicilline) | ||
| Penicilline | |||
| antistafilococciche Rischio di antagonismo, | Selezione di mutanti | Da evitare | |
| (deboli induttrici di fallimento terapeutico | derepressi iperproduttori | ||
| penicillinasi) (+ aumento del rischio | di β-lattamasi per | ||
| di epatotossicità) | l’associazione di una | ||
| penicillina debole induttrice | |||
| di β-lattamasi (isossazolil- | |||
| penicilline) con | |||
| Co- amoxiclav, induttore | |||
| potente di β-lattamasi | |||
| (continua) | |||
| Altri antibiotici o | Mezzi di prevenzione | Comportamento | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Antibiotico | altri medicamenti | Tipo di rischio | Fattori favorenti | Meccanismo | o correzione | da adottare | |||
| Clorochina | Riduzione dell’assorbimento Assunzione | Evitare l’asunzione | Da assumere con cautela | ||||||
| digestivo dell’amoxicillina | simultanea | simultanea (intervallo | |||||||
| di 3 ore tra le due | |||||||||
| somministrazioni) | |||||||||
| Co- amoxiclav iv | Aminoglucosidi | Rischio di inattivazione | Insufficienza renale | Formazione di un’amide | Scegliere l’aminoside più | Da utilizzare con cautela | |||
| in perfusione iv | dell’aminoside da parte del | Posologia elevata di | biologicamente inattiva | stabile all’inattivazione da | |||||
| Co- amoxiclav | Co- amoxiclav | parte del Co- amoxiclav: | |||||||
| Iniezione nello stesso | amikacina, netilmicina, | ||||||||
| flacone di perfusione | tobramicina Iniettare | ||||||||
| separatamente i due | |||||||||
| antibiotici con due diversi | |||||||||
| flaconi di infusione | |||||||||
| Principio attivo | Via di somministrazione | Posologia media giornaliera | |
|---|---|---|---|
| Penicillina G potassica Penicillina G sodica Penicillina V (o fenossimetilpenicillina) Penicillina G benzatina | via parenterale (im) via parenterale (im, ev) via orale via parenterale (im) | 2000000- 50000000 U. a seconda della gravità dell’infezione 2000000- 50000000 U. a seconda della gravità dell’infezione da 200000- 400000 U. 600000- 1200000 ogni 15- 30 giorni | |
| Benzil- penicillina procaina+ benzil- penicillina potassica+ benzil- penicillina benzatina | via parenterale (im) | Per profilassi: 1200000 U. ogni 15- 30 giorni | |
| Oxacillina sodica | via parenterale (im, ev) | A.: 250- 500 mg ogni 6 ore; B.: 25- 50 mg/kg/die | |
| Cloxacillina sodica | via parenterale (im, ev) | 50- 100 mg/kg/die | |
| Dicloxacillina sodica | per os via parenterale (im, ev) | A.: 2 g/die in 4 somministrazioni; B.: 1 g/die in 4 somministrazioni | |
| Flucloxacillina sodica | per os via parenterale (im) | Per os: A.: Capsule: 500 mg ogni 6 ore; Compresse: 1 g ogni 6-8 ore; B. (8-14 anni): 500 mg ogni 8 ore Iniettabile im: A.: 1g ogni 8 ore; B.: fino a 100 mg/kg/die in dosi refratte (non superare 33 mg/kg per iniezione) | |
| Meticillina sodica | per uso topico | Per os: | |
| Ampicillina (acida, triidrata o sodica) | per uso topico per os via parenterale (im, ev) via parenterale (im) | A.: 2- 3 g/die in dosi refratte; B. (5- 11 anni): 500 mg ogni 6 ore; B. (0- 5 anni): 100 mg/kg/die in 4 somministrazioni Iniettabile im/ ev: A.: 2- 3 g/die in dosi refratte; B. (5- 11 anni): 500 mg ogni 8 ore; B. (0- 5 anni): 100 mg/kg/die in 3 somministrazioni | |
| Bacampicillina | per os | A.: 800- 1200 mg ogni 12 ore; B (> 7 anni): 400 mg ogni 12 ore | |
| Ampicillina + Cloxacillina | per os per via parenterale (im) | A.: 1-2 capsule da 375 mg ogni 4-6 ore A. e B.: 2-3 flaconi al giorno, secondo prescrizione medica | |
| Ampicillina+ Sulbactam | per via parenterale (im, ev) | La dose totale giornaliera raccomandata per l’adulto varia entro un range di norma compreso tra i 3 e i 12 g e può essere refratta in somministrazione uguali ogni 12, 8 o 6 ore. La scelta del dosaggio dipenderà dalla gravità dell’infezione. B.:150 mg/kg/die somministrati in dosi refratte ogni 6-8-12 ore. | |
| Amoxicillina (triidrato, sale sodico) | per os via parenterale (im, ev) | Per os: A.: 500- 1000 mg ogni 8- 12 ore; B.: 50-75 mg/kg/die in 2-3 somministrazioni Iniettabile im/ev: A.: 500- 1000 mg 2-3 volte al dì; B.: 50- 100 mg/kg/die in 2-3 somministrazioni | |
| Amoxicillina/ ac. clavulanico | per os via parenterale (ev) | Per os: A. e B. (>40 kg): 1 g 2-3 volte al dì; B. (5- 10 kg): 125 mg ogni 12 ore; B. (10- 13 kg): 250 mg ogni 12 ore; B. (13- 25): 312,5 mg ogni 12 ore; | |
| (continua) | |||
Principio attivo Via di somministrazione Posologia media giornaliera
B. (25- 40 kg): 625 mg ogni 12 ore
Iniettabile ev:
A.: 600- 1200 mg (lentamente) ogni 8 ore (fino a 2,2 g ogni 8 ore);
B. (fino a 3 mesi): 55 mg/kg ogni 12 ore;
B. (3 mesi- 12 anni): 27,5 mg/kg ogni 6 ore
Ticarcillina/ ac. clavulanico via parenterale (im, ev)Iniettabile ev: A.: 3,2 g ogni 6- 8 ore Iniettabile im: B.: 1,2 g ogni 8- 12 ore
Mezlocillina sodica via parenterale ( im, ev)A e B (>20 kg): 1 g 2-3 volte al giorno; B (>13 kg): 500 mg 2-3 volte al giorno; Neonati e lattanti fino a due anni (<13 kg): 250 mg 2- 3 volte al giorno
Piperacillina sodica via parenterale ( im, ev)Iniettabile im: A.: 2 g 2 volte al giorno; B (>6 anni): 1 g 2 volte al giorno; B (<6 anni): 500 mg 2 volte al giorno Iniettabile ev: A.: 150- 300 mg/kg/die (fino a 24 g/24 h) suddivisi in più somministrazioni; B.: 100- 300 mg/kg/die suddivisi in più somministrazioni
Piperacillina/ tazobactam via parenterale ( im, ev)Iniettabile im: A e B (>12 anni): 2 g/ 0,250 g (piperacillina/ tazobactam) ogni 12 ore; B (<12 anni): sconsigliato Iniettabile ev: A e B (>12 anni): 2 g/ 0,250 g (piperacillina/ tazobactam) (fino ad un massimo di 4 g/ 0,5 g) ogni 6- 8- 12 ore; B (<12 anni): sconsigliato
| Batteri Cefalosporine | Cefalosporine di seconda generazione | |
|---|---|---|
| di prima | ||
| generazione | ||
| Cefalotina, | ||
| Cefaloridina, | ||
| Cefazolina | Cefuroxima CefotiamCefamandolo, | |
| e derivati | sodica Ceforanide (cloridrato)Cefonicid | Cefpiramide* |
| Cocchi Gram negativi | ||
| Gonococchi +++ | +++ ++++ ++ ++++ | ++++ |
| Meningococchi +++ | ++ +++ ++++ +++ | |
| Treponema +++ | +++ +++ +++ ++++ | +++ |
| Cocchi Gram negativi anaerobi | ||
| E. coli ++ | +++ +++ +++ +++ | ++ |
| Klebsiella + | + ++ ++ +++ | ++ |
| Enterobacter cloacae R | R + R ++ | ++ |
| Citrobacter R | + ++ R ++ | R |
| Serratia R | R R R + | R |
| Proteus indolo +: | ||
| Proteus morganii R | + R + | ± |
| Proteus vulgaris R | + R R R | + |
| Proteus rettgeri R | ± + R +++ | + |
| Proteus providencia R | R ++ R ++ | ± |
| Proteus mirabilis ++ | +++ +++ +++ ++++ | ++ |
| Brucella | ||
| Campylobacter jejuni R | R R R R | R |
| Bacilli Gram negativi | ||
| Pseudomonas | ||
| aeruginosa R | R R R R | +++ |
| Yersinia enterocolitica R | R ++ | ± |
| Salmonella + | +++ + +++ ++++ | ++ |
| Shigella ++ | +++ ++ +++ | ++ |
| Pasteurella | +++ | |
| Haemophilus + | +++ ++++ + +++ | +++ |
| Branhamella catarrhalis + | +++ +++ +++ +++ | +++ |
| Bacilli Gram negativi anaerobi | ||
| Bacteroides fragilis R | R R R R | R |
| Fusobacterium +++ | ++++ ++++ ++++ | |
| Clostridium perfrigens ++ | ++ ± + | |
| Peptococco e | ||
| Peptostreptococco ++ | ++ ++++ +++ | |
| Bacilli Gram positivi | ||
| Listeria R | R ++ R R | R |
| Corynebacterium, | ||
| Proprionibacterium, | ||
| Actinomyces | ||
| Nocardia R | R R R R | R |
| Cocchi Gram positivi | ||
| Streptococco A ++++ | ++++ ++++ ++++ ++++ | ++++ |
| Streptococco B +++ | +++ +++ +++ +++ | +++ |
| Streptococco viridans +++ | +++ +++ +++ +++ | +++ |
| Enterococco R | R R R R | + |
| (streptococco fecale D) | ||
| Pneumococco meti-S ++++ | +++ +++ +++ +++ | +++ |
| Stafilococco meti-S ++++ | +++ +++ +++ +++ | +++ |
| Stafilococco meti-R R (+ per | R R R R | R |
| cefaloridina) | ||
* Secondo alcuni Autori di 3a generazione.
| Batteri | Cefamicine | ||||
|---|---|---|---|---|---|
| Cefoxitina | Cefmetazolo | Cefminox | Cefbuperazone | Cefotetan | |
| Batteri Gram positivi | |||||
| Listeria | R | R | R | R | R |
| Corynebacterium | ++ | + | ++ | ||
| Proprionibacterium | |||||
| Actinomyces | |||||
| Nocardia | R | R | R | R | R |
| Cocchi Gram positivi | |||||
| Streptococchi A | +++ | +++ | + | +++ | |
| Streptococchi B | +++ | +++ | + | + | |
| Streptococchi viridans | + | +++ | + | ++ | |
| Streptococco fecalis D | R | R | R | R | R |
| Pneumococco | + | + | ++ | ++ | ± |
| Stafilococco meti-S | ++ | +++ | + | ± | ± |
| Stafilococco meti-R | R | R | R | R | R |
| Bacilli Gram negativi aerobi | |||||
| Pseudomonas aeruginosa | R | R | R | R | R |
| Yersinia enterocolitica | + | ++ | +++ | +++ | |
| Salmonella | + | +++ | ++++ | +++ | ++++ |
| Shigella | +++ | +++ | +++ | ++ | |
| Pasteurella | |||||
| Haemophilus | |||||
| Branhamella catarrhalis | + | + | +++ | +++ | +++ |
| E. coli | ++ | +++ | +++ | +++ | ++++ |
| Klebsiella | ++ | +++ | +++ | +++ | +++ |
| Enterobacter cloacae | R | R | R | + | R |
| Acinetobacter | R | ||||
| Citrobacter | R | ± | R | ++ | + |
| Serratia | R | R | R | ++ | + |
| Proteus indolo +: | |||||
| Morganii | ++ | + | +++ | ++ | ± |
| Vulgaris | ++ | ++ | +++ | +++ | +++ |
| Rettgeri | + | ++ | +++ | + | |
| Providencia | ++ | ++ | ++ | ++ | ++ |
| Proteus mirabilis | +++ | +++ | +++ | +++ | ++++ |
| Brucella | |||||
| Campylobacter Jejuni | R | R | + | R | R |
| Anaerobi | |||||
| Bacteroides fragilis | ++ | + | +++ | ++ | ++ |
| Fusobacterium | + | +++ | R | ++++ | |
| Clostridium perfrigens | ++ | +++ | R | ++++ | |
| Peptococco e | ++ | ++ | ++ | + | ++ |
| Peptostreptococco | |||||
| Batteri Gram negativi | |||||
| Gonococco | ++++ | ++++ | ++++ | ++++ | ++++ |
| Meningococco | +++ | +++ | +++ | +++ | +++ |
| Treponema, Borrelia | ++++ | ++++ | ++++ | ++++ | ++++ |
| Batteri Cefotaxime | Ceftizoxime | Latamoxef | Flomoxef | Ceftazidima | Ceftriaxone | Cefoperazone | Cefmenoxime | Cefepime |
| Bacilli Gram negativi-anaerobi | ||||||||
| E. coli ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | ++++ | +++ |
| Klebsiella ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++ | ++++ | +++ |
| Enterobacter cloacae + | + | + | ± | ± | R | ± | ++ | +++ |
| Citrobacter + | ++ | ± | ++ | ++ | +++ | |||
| Serratia ++ | ++ | ++ | ++ | +++ | ++ | + | ++ | +++ |
| Proteus indolo +: | ||||||||
| morganii +++ | +++ | +++ | ++ | ++++ | ++++ | ++ | +++ | +++ |
| vulgaris ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | + | ++++ | +++ |
| rettgeri ++++ | ++++ | ++++ | +++ | ++++ | ++++ | ++ | ++++ | +++ |
| providencia +++ | +++ | +++ | +++ | +++ | +++ | ++ | +++ | +++ |
| mirabilis ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | ++++ | ++++ |
| Brucella | ++++ | |||||||
| Campylobacter jejuni ± | R | R | ± | R | R | |||
| Pseudomonas + | + | R | R | +++ | + | ++ | + | ++ |
| aeruginosa | ||||||||
| Acinetobacter R | ± | R | R | ++ | R | R | ± | ++ |
| baumanii | ||||||||
| Yersinia enterocolitica +++ | +++ | +++ | +++ | +++ | +++ | +++ | ||
| Salmonella ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | ++++ | ++++ |
| Shigella ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | ++++ | ++++ |
| Pasteurella ++++ | +++ | ++++ | ++++ | |||||
| Haemophilus, ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | ++++ | ++++ |
| Moraxella catarrhalis ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | ++++ | ++++ |
| Anaerobi | ||||||||
| Bacteroides fragilis R | ++ | ++ | +++ | R | R | ++ | ± | — |
| Fusobacterium ++++ | + | + | +++ | +++ | ++++ | ++ | ++ | + |
| Clostridium perfrigens ++ | ++ | ++ | + | ++ | ++ | ++ | ++ | |
| Peptococco e | ||||||||
| peptostreptococco +++ | +++ | ++ | ++ | + | ++ | ++ | +++ |
BETA-LATTAMINE
(continua)
| Batteri | Cefotaxime | Ceftizoxima | Latamoxef | Flomoxef | Ceftazidima | Ceftriaxone | Cefoperazone | Cefmenoxime | Cefepime |
| Bacilli Gram positivi | |||||||||
| Listeria e | R | R | R | R | R | R | R | R | — |
| Corynebacterium | |||||||||
| J, K e D2 | |||||||||
| Bifidobacterium, | +++ | ++++ | + | ++ | ++++ | +++ | |||
| Propionibacterium. | |||||||||
| Actinomyces | |||||||||
| Nocardia, | R | R | R | R | R | R | R | R | |
| Rhodococcus equi | |||||||||
| Cocchi Gram positivi | |||||||||
| Streptococco A | ++++ | ++++ | ++ | +++ | +++ | ++++ | +++ | ++++ | +++ |
| Streptococco B | ++++ | ++++ | ± | +++ | +++ | ++++ | ++ | +++ | +++ |
| Streptopcocco viridans | ++++ | ++ | ++ | +++ | + | ++++ | ++ | +++ | +++ |
| Streptococco | R | R | R | R | R | R | R | R | R |
| fecale (D) | |||||||||
| Pneumococco | ++++ | +++++ | ++ | +++ | +++ | ++++ | +++ | ++++ | +++ |
| Stafilococco meti-S | ++ | ++ | ± | ++++ | + | + | ++ | ++ | +++ |
| Stafilococco meti-R | R | R | + | R | R | R | R | R | R |
| Cocchi Gram negativi | |||||||||
| Gonococco | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ |
| Meningococco | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ |
| Treponema, Borrelia | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ |
VADEMECUM DEGLI ANTIBIOTICI
| Cefpodo- | |||||||
|---|---|---|---|---|---|---|---|
| Cefetamet | Cefteram | xime | Cefditorem | Cefotiam | |||
| Batteri | Cefixime | Ceftibuten | pivoxile | pivoxile | proxetile | pivoxile | exatile |
| E. coli | ++++ | ++++ | ++++ | ++++ | ++++a | ++++ | +++ |
| Klebsiella | ++++ | ++++ | ++++ | ++++ | ++++a | ++++ | +++ |
| P.mirabilis | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | +++ |
| P.vulgaris | ++++ | ++++ | ++++ | ++++ | ++++b | +++ | R |
| P.rettgeri | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | |
| P.stuarti | ++++ | ++++ | ++++ | ++ | ++++ | +++ | |
| M.morganii | + | ++++ | R | +++ | +b | +++ | R |
| Serratia | +++ | ++++ | +++a, b | ++ | ++b | ++ | R |
| E.aerogenes | +++ | ++++ | ++++a, b | ++++ | ++++ | ++ | R |
| E.cloacae | + | + | ++a, b | +++ | ++b | ++ | R |
| Citrobacter freundii | ± | ++ | ++ | ++++ | + | ++ | ++ |
| Moraxella catarrhalis | |||||||
| ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | |
| Salmonella | |||||||
| Shigella | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | +++ |
| H.influenzae | ++++ | ++++ | ++++ | ++++ | ++++ | +++ | +++ |
| Neiserria gonorhoeae | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ |
| Staphyl.aureus spp. | R | R | R | R | R | R | R |
| Staphyl.aureus meti-S | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ | ++++ |
| Pneumococco, | |||||||
| Streptococcus pyogenes | R | ± | R | + | + | +++ | +++ |
| ++ | ++ * | ++++ | ++++ | ++++ | ++++ | ++++ | |
| +++ | pneumocco | ++++ | |||||
| pem-R ± | |||||||
- a.
- Ad eccezione dei ceppi produttori di beta-lattamasi ad ampio spettro
- b.
- Ad eccezione dei mutanti attivati iperproduttori di cefalosporinasi di classe I
- *
- Il ceftibuten è attivo sugli streptococchi di ceppo A ma non su quelli di ceppo B
- R.
- resistente
| Cefalotina | Cefaloridina | Cefacetrile | Cefapirina | Cefazolina | |
|---|---|---|---|---|---|
| Emivita (minuti) | 30-40 | 80-90 | 70-80 | 30-40 | 100-120 |
| Picco sierico (µg/ml) dopo 1000 mg | im 20 iv 30-40 | im 30 iv 40-60 | im 20 iv 60 | im18-20 iv 70 | im 60-65 iv 180 |
| % legame con le proteine plasmatiche | 65 | 15-20 | 30 | 50 | 85 |
| Biotrasformazione metabolica | desacetilazione 30% | – | desacetilazione 20% | desacetilazione 20-30% | – |
| Volume di distribuzione (1/1.7 m2) | 19 (0.28 l/Kg) | 16 | 25 | 15 | 10 |
| Diffusione LCR | - | - | ± | - | - |
| Tasso biliare | ± | ± | ± | ± | ++ |
| % eliminazione urinaria (24 ore) | 65 | 90 | 85 | 60-80 (20-30 desacetilata) | > 85 |
| Clearance totale (ml/min) | 475-500 | 165 | 380 | 550 | 65-70 |
| Clearance renale (ml/min) | 240 | 120 | 280-320 | 350 | 60 |
| Picchi urinari (µg/ml) dopo 1 g | 1600-2000 | 3000-4000 | 1500-3500 | 1500-2000 | 3000-4000 |
| Modalità di eliminazione renale | G+T | G | G+T | G+T | G+T |
G = filtrazione glomerulare; T = secrezione tubulare G = filtrazione glomerulare; T = secrezione tubulare.
| Cefamicine | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Cefaman- | Cefoni- | Cefuro- | Cefora- | Cefo- | Cefpira- | Cefoxi- | Cefote- | Cefme- | Cefbupe |
| dolo | cid | xima | nide | tiam | mide | tina | tan | tazolo | razone |
| Emivita (minuti) | 65-70 | 240-280 | 70 | 180 | 60-65 | 280-300 (5 h) | 45 | 180-250 | 68-80 | 95 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Picco sierico (µg/ml) dopo 1000 mg | im 20 iv 70-160 | im 98-110220 | ev | im 30-40 iv 110-150 | im 49 iv 60-75 | im 15-17 iv 125 | iv 170-240 | im 35-30 iv 80-120 | im 50-35 iv 40-150 | im 50 | |
| % legame con le proteine plasmatiche | 75 | 95 | 33 | 85 | 40-55 | 85-95 | 70-75 | 85-91 | 55 | 85 | |
| Biotrasformazione metabolica | - | - | - | - | - | - | - | - | - | - | |
| Volume di distribuzione 1/1.73 m2) | 14 (0. 22 l/kg) | 8-9 | 18 (0.36 l/kg) | 12 | 34 (0.55 l/kg) | 10 (0.15 l/kg) | 8-12 | 8-9 (0.18 l/kg) | 10 | ||
| Diffusione LCR | - | - | - | - | + | ± | - | - | + | ||
| Tasso biliare | ++ | ± | ++ | - | +++ | ++++ 70% eliminazione biliare | ++ | +++ (20% eliminazione biliare) | +++ | +++ (10% eliminazione biliare) | |
| % eliminazione urinaria (24 h) | 80 | 85-95 | 95-100 | 85-90 | 65-70 | 15-25 | 90 | 60-70 | 80-90 | 75 | |
| Clearance totale (ml/min) Clearance renale (ml/min) Picchi urinari (µg/ml) dopo 1 g | 250 155 1500-3000 | 25-30 18-20 1000-1500 | 200 135 4000-6000 | 45-60 35 2500-3000 | 380-385 245 500-3000 | 40 4-5 | 250-330 250-300 1500-4000 | 40-50 30 2500 | 130 100-110 2000 | ||
| Modalità di eliminazione renale | G + T | G + T | G + T | G | G + T | G | G + T | G + T | G + T | G + T | |
BETA-LATTAMINE
VADEMECUM DEGLI ANTIBIOTICI
| Cefotaxime | Ceftizoxime | Latamoxef | Flomoxef | Ceftazidima | Ceftriaxone | Cefmenoxime | Cefoperazone | Cefsulodine | Cefpirome | Cefepime | Cefodizime | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Emivita (min) | Cefotaxime 65-80 Desacetil-cefotaxime 100-150 | 90-110 | 150 | 50-60 | 110 (1.8 h) | 380-480 | 75-80 | 120-150 | 100-120 | 95-110 (2.2-2.3 h) | 120 (2 h) | 120-240 | ||||||||
| Picco sierico (µg/ml) dopo 1000 mg | im 25-35 iv 110 | im (0,5 g) 8 ev (1 g) 112 | im 30-50 iv 70-80 45 | im 40 iv 120 | im 90-150 iv 250 | im 40 iv 120-160 | im 60-65 iv 135-160 | im 29 iv 60-90 | im 19-22 iv 100 | im 15-25 iv 80 | im 180-250 iv 50-80 | |||||||||
| % legame con le proteine plasmatiche 36 | 31 | 40-50 | 35-40 | 20 | 90-95 (saturabile) | 60-70 | 87-93 | 15-20 | < 10 | < 19 | 80-90 | |||||||||
| Biotrasformazione metabolica | Desacetilazione (20%) - | - | - | - | - | - | - | - | - | - | - | |||||||||
| Volume di distribuzione (1/1.73 m2) | 25 (0.25 l/kg) | 16-18 30 (frazione libera) | 22 (0.34 l/kg) | 14-18 (0.29 l/kg) | 9-12 a seconda del dosaggio | 22-23 | 9.5 (0.24 l/kg) | 15-17 (0.25 l/kg) | 20 | 18-20 |
|
|||||||||
| Diffusione LCR | + (9%) | + | ++ (20%) | ++ | + (9%) | + | + | + | ||||||||||||
| Tasso biliare | + (5-10%) | (1%) | + (5%) | ± (1%) | +++ (40% eliminazione biliare) | ++++ (70-80% eliminazione biliare) | + (< 1%) | ± | +++ (10% eliminazione biliare) | |||||||||||
| % eliminazione urinaria (24 h) | 50-60 + 20 metaboliti | 80 | 65-90 | > 90 | 95 | 50-60 | 75-80 | 25-30 | 80 | 88-90 (G) | 90 (G) | > 80 | ||||||||
| Cefotaxime | Ceftizoxime | Latamoxef | Flomoxef | Ceftazidima | Ceftriaxone | Cefmenoxime | Cefoperazone | Cefsulodine | Cefpirome | Cefepime | Cefodizime | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Clearance totale ml/min) | 200-245 | 135-150 | 85-115 | 110-120 | 10-18 a seconda del dosaggio | 285 | 85-90 | 145 | 150 | 125 | 40-60 | |
| Clearance renale (ml/min) | 145 |
|
55-70 | 90 | 6-13 | 150-180 | 18-25 | 100-105 | 120 |
|
30-35 | |
| Picchi urinari (µg/ml) dopo 1 g | 1000-1500 | 1500 | 2500 | 500-1000 | 1000 | 3000 | 2200 iv 800-900 im | 2000 | 2500-3500 | 900 | > 5000 | |
| Modalità di eliminazione renale | G + T | G + T | G | G | G | G | G + T | G | G | G | G | G |
G = filtrazione glomerulare; T = secrezione tubulare
BETA-LATTAMINE
VADEMECUM DEGLI ANTIBIOTICI
| % assorbi | % legame con Clearance | Clearance | Biotrasfor | % | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| mento | Picchi sierici | le proteine | totale | renale (ml/ | mazione | eliminazione | Picchi urinari | |||||||||
| Cefalosporine | gastroenterico | (µg/ml) | Emivita (h) | plasmatiche | (ml/min) | min) | metabolica | V.D. (l) | urinaria (24 h) | (µg/ml) | ||||||
| Cefalexina 500 mg | > 90 | 18-20 | 1 | 10 | 250-280 | 200-250 | - | 21 | > 90 (G+T) | 1000-1500 | ||||||
| Cefadroxil 500 mg | > 90 | 15 | 1.3 | 15-18 | 180-200 | 150-180 | 20 | 90 | 1000 | |||||||
| Cefradina 500 mg | > 90 | 18-20 | 0.8-0.9 | 5-10 | 360-480 | 300-360 | - | > 95 | 1000-1500 | |||||||
| Cefatrizina 500 mg | 50-60 | 7-10 | 1.5-2 | 60 | 210-240 | 150-200 | - | 18 | 60-70 | |||||||
| Cefroxadina | 90 | 12-14 | 1 | 10 | 340 | 250-300 | - | 95 | > 1500 | |||||||
| Cefaclor 500 mg | 70-80 | 12-13 | 0.6-0.9 | 25-30 | 300-350 | 250-300 | - | 20 | 80 | 900-1000 | ||||||
| Loracarbef 250 mg | 80-90 | 12-15 | 0.8-1 | 30-35 | 225 | 210 (G + T) | - | 23 | 90 (G+T) | |||||||
| Cefprozil 500 mg | 80 | 11-12 | 1.3 | 45 | 160-190 | 65-70 (G+T) | ||||||||||
| Cefdaloxima | > 60 | 3.5-4 | 2-2.4 | 160 | 95-100 | - | ||||||||||
| pentexil tosilato | ||||||||||||||||
| Cefuroxime axetil | 30-40 a | 6-9 | 1.2-1.4 | 35 | 165 | 150 | - | 30-40 (G+T) | > 100 | |||||||
| 500 mg | digiuno 50-60 dopo i | |||||||||||||||
| pasti | ||||||||||||||||
| Cefixima 400 mg | 40-50 | 3.4-5 | 3-4 | 70 | 130 | 22-35 | - | 15 | 20-30 | 80-90 | ||||||
| Cefotiam exetile 400 mg | 42-45 | 3.5-4 | 1 | 40 | 280 | 250 | - | 35-40 (0.5 l/kg) | 30-35 (G+T) | |||||||
| Cefetamet pivoxil 1000 mg | 40 a digiuno 50 dopo i pasti | 8-10 | 2.3 | 22 | 140 | 120 | - | 18 | > 90 (G) | |||||||
| Cefteram pivoxil 400 mg | 40 a digiuno 60 dopo i pasti | 3.8 | 1.2 | 60 | + | 25 | ||||||||||
| Cefpodoxima proxetil 200 mg | 80 | 2.5 | 2-2.5 | 30-40 | 110-130 | + | 30-35 (0.4 l/kg) | 40-50 (G+T) | ||||||||
| + | ||||||||||||||||
| Ceftibuten 200 mg | > 90 | 10-11 | 2-3 | 65-70 | 70 | 50-60 | (trans) | 85-90 | ||||||||
| Cefdinir | 60 | 65 (G+T) | 500-600 | |||||||||||||
| Cefprozil 500 mg | 40 | 9-10 | 1.25-1.4 | 300 | 180-210 (G+T) | 90 | ||||||||||
Altri antibiotici Germi interessati ed Cefalosporina o farmaci Effetto ottenuto Meccanismo indicazioni principali
Cefalosporine antistafiloccociche: cefamandolo, cefotaxima, cefdinir
Cefalosporine antistafilococciche: cef1, cefamandolo, cefuroxima. Cefotetan, cefdinir, cefditoren
Cefalosporine antistafilococciche
Cefalosporine antistafilococciche
Cefalosporine antistafilococciche
Cefalosporine antistafilococciche
Cefalosporine antistafilococciche
Cefalosporine 3 e 4 anti-Pseudomonas : ceftazidima, cefsulodina, cefepime, cefpirome
Fosfomicina iv
Glicopeptidi
Co-trimoxazolo
Acido fusidico
Streptogramine
Aminosidi
Fosfomicina iv
Sinergia antibatterica + inibizione delle resistenze batteriche + diffusione nel LCR
Effetto additivo o sinergico + inibizione delle resistenze batteriche + aumento dei tassi ematici per competizione sulla secrezione tubulare
Effetto additivo o sinergico
Effetto additivo o sinergico + inibizione delle resistenze batteriche
Sinergia antibatterica + inibizione delle resistenze batteriche
Sinergia + inibizione delle resistenze batteriche
Effetti antibatterici additivi o sinergici + inibizione delle resistenze batteriche
Sinergia antibatterica + inibizione delle resistenze batteriche
Inibizione sequenziale della sintesi della parete batterica, inibizione della PBP 2a ad opera della fosfomicina
Azione su diversi bersagli batterici: inibizione della parete batterica (cefalosporine) o inibizione della DNA-girasi (fluorochinoloni)
Inibizione sequenziale della sintesi della parete batterica
Azione su bersagli batterici differenti: inibizione della sintesi della parete batterica (cefalosporine), effetto antifolico (co-trimoxazolo)
Aumento dell’azione battericida. Azione su bersagli batterici differenti: inibizione della parete batterica (cefalosporine), inibizione dell’RNA batterico (rifampicina)
Azione su bersagli batterici differenti: inibizione della parete batterica (cefalosporine), inibizione della sintesi delle proteine (acido fusidico, streptogramine)
Azione su bersagli batterici differenti: inibizione della parete batterica (cefalosporine), inibizione della sintesi delle proteine batteriche (aminosidi)
Aumento dell’attività battericida per inibizione sequenziale della sintesi della parete batterica Stafilococchi meti-R Pneumococci resistenti alla penicillina. Localizzazione meningea ed endocardica
Stafilococchi
Stafilocchi a sensibilità diminuita. Penumococchi resistenti alla penicillina
Stafilococchi
Stafilococchi meti-R, pneumococchi resistenti alla penicillina (meningiti)
Stafilococchi meti-R
Stafilococchi meti-S e qualche volta meti-R (se sono ancora sensibili agli aminosidi)
Pseudomonas, enterobatteri
BETA-LATTAMINE
(continua)
Altri antibiotici Germi interessati ed Cefalosporina o farmaci Effetto ottenuto Meccanismo indicazioni principali
Cefalosporine 3 e 4 anti-
Pseudomonas
Cefalosporine 3 e 4 generazione, soprattutto anti-Pseudomonas
Cefalosporine 3 e 4 anti-
Pseudomonas
Cefalosporine 3 e 4 anti-
Pseudomonas
Cefalosporine 3 e 4 anti-
Pseudomonas
Cefalosporine 3 e 4 anti-Pseudomonas (ceftazidima)
Cefalosporine 3 e 4
Aminosidi
Fluorochinoloni a “duplice azione” Cefalosporine 3fluorochinolone
Altre beta-lattamine anti-Pseudomonas: penicilline anti-Pseudomonas: carbossipenicilline, ureidopenicilline, aztreonam (ma rischio di resistenza crociata)
Polimixina - colistina
Co-trimoxazolo
Aminopenicilline
Sinergia antibatterica + inibizione delle resistenze batteriche
Effetti antibatterici additivi o sinergici + inibizione delle resistenze batteriche + aumento reciproco dei tassi ematici per competizione sulla secrezione tubulare
Potenziamento degli effetti antibatterici, inbizione delle resistenze batteriche, assenza di nefrotossicità
Sinergia antibatterica + inibizione delle resistenze batteriche
Sinergia antibatterica
Allargamento dello spettro antibatterico, inibizione delle reistenze batteriche
Ampliamento dello spettro a Listeria, streptococco B, enterococco (meningite neonatale) Aumento, ad opera delle cefalosporine, della permeabilità della parete batterica facilitante l’accesso dell’aminoside ai bersagli batterici
Azione su bersagli batterici differenti: inibizione della sintesi della parete batterica (cefalosporinasi), inibizione della DNA girasi (fluorochinoloni)
Competizione sulla secrezione tubulare che comporta un aumento reciproco dei tassi ematici
Azione sui differenti bersagli batterici: parete batterica (cefalosporine), RNA batterico (rifampicine)
Azione coniugata sulla membrana batterica (polimixina) e sulla parete batterica (cefalosporine)
Azione su diversi bersagli batterici: inibizione della sintesi della parete batterica (cefalosporine), azione antifolica (co-trimoxazolo)
Inclusione dei germi non sensibili alle cef 3 (meningiti neonatali + infezioni da enterococco) Pseudomonas, enterobatteri
Enterobatteri, Pseudomonas (soprattutto ciprofloxacina), stafilococchi
Pseudomonas, insufficienza renale: permette di evitare l’associazione con un aminoside nefrotossico
Pseudomonas, enterobatteri
Enterobatteri, Pseudomonas (soprattutto infezioni urinarie)
Pseudomonas maltophila, cepacea, pseudomallei, flavobacterium
Listeria, enterococco, streptococco B, enterobatteri
VADEMECUM DEGLI ANTIBIOTICI
BETA-LATTAMINE
| Altri antibiotici | Germi interessati ed | |||
| Cefalosporina | o farmaci | Effetto ottenuto | Meccanismo | indicazioni principali |
| Cefalosporine anti-anaerobi (cefamicina, latamoxef) | Nitroimidazoli, clindamicina, cloramfenicolo, carbapenemi | Azione antibatterica additiva o sinergica, inibizione delle resistenze batteriche | Azione sui bersagli batterici differenti: inibizione degli acidi nucleici batterici (nitroimidazolo), inibizione della sintesi delle proteine batteriche (clindamicina, cloramfenicolo), inibizione della sintesi della parete batterica (cefalosporine) | |
| Cefalosporine 3 (soprattutto cefoperazone) | Inibitori delle betalattamsi (sulbactam, tazobactam) | Allargamento dello spettro antibatterico, aumento dei tassi ematici delle cefalosporine | Inibizione delle beta-lattamasi a largo spettro (Klebsiella, E. coli) + competizione sulla secrezione tubulare (ad eccezione delle cefalosporine eliminate esclusivamente per filtrazione glomerulare: cefoperazone, cefsulodine, latamoxef) | Enterobatteri secretori delle beta-lattamasi a spettro allargato (Klebsiella) |
| Cefalosporine eliminate soprattutto per secrezione tubulare: cefotaxima, cefmenoxima, cefamandolo, cefuroxima, cefotiam, cefpiramide, tutte le cefamicine e le cef1 | Probenecid | Aumento dei tassi ematici e nel LCR. Aumento della emivita delle cefalosporine | Competizione sulla secrezione tubulare | Meningiti batteriche (cef3 e cef4), setticemie, endocarditi |
| (ad eccezione della cefaloridina) |
| Antibiotico | Altri anti-infettivi | Tipo di rischio | Fattori favorenti | Meccanismo | Mezzi di prevenzione o correzione | Comportamento da adottare |
|---|---|---|---|---|---|---|
| Cefalosporine scarsi induttori delle betalattamasi: cef3 e cef4 | Beta-lattamine induttori potenti delle beta-lattamasi: penicillina G, aminopenicilline, carbapenemi. Cefamicine, latamoxef | Rischio di scacco terapeutico e di superinfezioni da germi resistenti | Infezioni da grandi popolazioni batteriche: ascessi profondi. Infezioni urinarie, endocardite, meningiti, etc. (eccesso di beta-lattamasi) | Induzione di una iperproduzione di cefalosporinasi cromosomiche ad opera di mutanti attivati (enterobatteri, citrobacter, morganella, serratia) e di beta-lattamasi a spettro allargato (klebsiella, etc) resistenti alle cef3 | Associazione di un inibitore delle beta-lattamasi alle cef3 - solamente per le beta-lattamasi a spettro allargato (klebsiella) | Sconsigliato |
| Cefaloridina e, in misura minore, cefalotina | Antinfettivi nefrotossici: aminosidi, vancomicina, | Rischio aumentato per nefrotossicità | Trattamento prolungato | Nefrotossicità additiva | Controindicato | |
| foscarnet. Pentamidina | ||||||
| iv, polimixina colistina. Medicamenti | ||||||
| nefrotossici: | ||||||
| ciclosporina, cisplatino, carboplatino, etc | ||||||
| Cefalosporine antistafilococciche | Penicilline antistafilococciche | Frequente resistenza crociata | Somministrazione simultanea | Da evitare | ||
| Cef3 e 4 | Penicilline a spettro molto ampio (ureidopenicilline, carbossipenicilline) | Frequente resistenza crociata | Somministrazione simultanea | Da evitare | ||
| Cef1 e 2 | Aminopenicilline | Resistenza crociata | Somministrazione simultanea | Da evitare |
| Antibiotico | Altri anti-infettivi | Tipo di rischio | Fattori favorenti | Meccanismo | Mezzi di prevenzione o correzione | Comportamento da adottare |
|---|---|---|---|---|---|---|
| Cefalosporine aventi una sostituzione N-metiltiotetrazolica in C3: cefamandolo Cefoperazone latamoxef | Anticoagualnti orali, eparina, ASA Alcool (bevande e farmaci) | Aumento del rischio di emorragia Rischio d’effetto Antabuse | Dosi elevate | Effetto ipoprotrombinizzante e trombopenico di queste cefalosporine | Somminstrazione profilattica e curativa di vitamina K durante il trattamento Evitare l’assunzione di alcolici durante il trattamento e 2-3 giorni dopo la sua sospensione | Sconsigliato |
| Cefalosporine orali esterificate di 2° e 3° generazione: cefuroxima axetil, cefpodoxima proxetil, etc. | Digestivi topici (Al Mg), anti H2, inibitori della pompa protonica | Riduzione della biodisponibilità orale delle cefalosporine | Assunzione simultanea | Inibizione dell’assorbimento digestivo delle cefalosporine orali esterificate (che è pH dipendente) | Rispettare un intervallo di 3-4 ore tra i due prodotti | |
| Ceftriaxone | Diazepam | Riduzione (sperimentale) dell’attività del | Somministrazione simultanea | Tenerne conto | ||
| diazepam | ||||||
| Furosemide | Riduzione (sperimentale) dell’effetto diuretico della | Dosi elevate | Adattamento della posologia dell’immunosoppressore | Tenerne conto | ||
| furosemide, ritardo dell’escrezione del | ||||||
| ceftriaxone | ||||||
| Ciclofosfamide | Aumento dell’effetto immunosoppressore | Meningiti batteriche | Rimpiazzare la cefalosporina con la rifampicina (meningiti) | Precauzioni di impiego | ||
| Desametasone | Riduzione della penetrazione (diffusione) della cef3 nel LCR per la presenza del desametasone | Somministrazione simultanea | Precauzione di impiego (meningite penumococcica) |
Cefalosporine FormulazioniPosologia giornaliera
| Cefalexina Cefadroxil | cps 500 mg, cpr 1g, gtt os 10%, sosp os 10%, sosp os 5% sosp os 5%, cpr 1g, cps 500 mg, Bambini: 50-100 mg/Kg/die | Adulti: 2-4 g suddivisi in 3-4 somministrazioni Bambini: 25-100 mg/Kg/die Adulti: 2-4 g suddivisi in 3-4 somministrazioni |
| Cefradina | cpr 1g, cps 500 mg, scir 5%, sosp os 500 mg/ 5ml, sosp os 250 mg/ 5ml, sosp os 125 mg/ 5ml, fl 250 mg im, fl 500 mg im, fl 1g im | Adulti: 1-2 g/die suddivisi in 2-4 somministrazioni Bambini: 25-100 mg/Kg/die suddivisi in 4 somministrazioni |
| Cefatrizina | sosp os 5%, sosp os 250 mg/5ml, sosp os 125 mg/ 5ml, cps 500 mg, cpr 500 mg | Adulti: 1-3 g/die suddivisi in 3-4 somministrazioni Bambini: 30-100 mg/Kg/die suddivisi in 2-4 somministrazioni |
| Cefaclor | fl 250 mg, cps 500 mg, os gtt 5%, sosp os 5%, cpr 750 mg | Adulti: 750 mg-2 g/die suddivisi in 3 somministrazioni Bambini: 20-40 mg/Kg/die suddivisi in 3 somministrazioni |
| Cefuroxime axetil | cpr riv 125 mg, cpr riv 250 mg, cpr riv 500 mg, sosp os 125mg/ 5 ml, sosp os 125mg/ 100 ml, bust 250 mg | Adulti: 250 mg- 1 g/die suddivisi in 2 somministrazioni Bambini di età inferiore a 6 anni: 20 mg/Kg/die suddivisi in 2 somministrazioni Bambini di età superiore a 6 anni: 500 mg/die suddivisi in 2 |
somministrazioni
Cefpodoxima cpr 100 mg, sosp os pediat. 40mg/5ml Adulti: 200- 400 mg/die suddivisi in 2 somministrazioni Bambini: 8 mg/Kg/die suddivisi in 2 somministrazioni
Cefixima cpr 400 mg, sosp os gran 2%Adulti: 400 mg/die in monosomministrazione Bambini: 8 mg/Kg/die in monosomministrazione
Cefprozil cpr 500 mg, sosp os 5%Adulti e bambini di età superiore a 12 anni: 500- 1000 mg/die Bambi di età compresa fra 6 mesi e 12 anni: 15- 20 mg/Kg/die suddivisi in 1-2 somministrazioni
Ceftibuten cps 400 mg, sosp os gran 14,4%Adulti: 400 mg in monosomministrazione Bambini: 9 mg/Kg/die in monosomministrazione
Cefetamet cpr 500 mg, scir 250 mg/ 5 mlAdulti e bambini di età superiore a 12 anni: 1g sdiviso in 2 somministrazioni Bambini di età inferiore a 12 anni: 20 mg/Kg/die suddivisi in 2 somministrazioni
Cefalotina fl 1 g im/ev, fl 2 g im/evAdulti: 2-6 g suddivisi in 6-4 somministrazioni Bambini: 100 mg/Kg/die suddivisi in di frazionate
Cefazolina fl 250 mg im, fl 500 mg im, Adulti: 1-3 g/die suddivisi in 2 somministrazioni fl 500 mg im/ev; fl 1g im, fl 1g im/ev Bambini: 30-50 mg/Kg/die suddivisi in 2 somministrazioni
Cefamandolo fl 500 mg im, fl 1 g im,fl 1g ev, Adulti: 2-8 g/die suddivisi in 3-6 somministrazioni fl 1 g im/ev Bambini: 50-100 mg/Kg/die suddivisi in 3-6 somministrazioni
Cefuroxima (im/ev) fl 250 mg im, fl 500 mg im, Adulti: 1,5-3 g/die suddivisi in 2-4 somministrazioni fl 750 mg im, fl 1000 mg im, Bambini: 30-100 mg/Kg/die 2-4 somministrazioni fl 1000 mg ev, fl 2g ev, fl 1000 mg im/ev,
Cefonicid f 500 mg im, f 1g im, f 1g evAdulti: 1-2 g in monosomministrazione Bambini: 50 mg/Kg/die in monosommistrazione
| Cefalosporine | Formulazioni | Posologia giornaliera |
|---|---|---|
| Cefoxitina | fl 1g im, fl 1g ev, fl 2g ev, fl 2g im | Adulti: 3-6 g/die suddivisi in 3 somministrazioni giornaliere Bambini: 20-40 mg/Kg/die suddivisi in 3-4 somministrazioni |
| Cefotetan | fl 1g im, fl 1g ev, fl 2g ev | Adulti: 1-2 g/die suddivisi in 1-2 somministrazioni Bambini: 20-60 mg/Kg/die suddivisi in 2 somministrazioni |
| Cefmetazolo | fl 500 mg im, fl 1g im, fl 2g ev | Adulti: 2-8 g/die suddivisi in 2-4 somministrazioni Bambini: 25-100 mg/Kg/die suddivisi in 2-4 somministrazioni |
| Cefotaxima | fl 250 mg im/ev, fl 500 mg im/ev, fl 1g im/ev, fl 1g im, fl 2g ev | Adulti: 2g/die suddivisi in 2 somministrazioni Bambini: 50-100 mg/Kg/die suddivisi in 2-4 somministrazioni |
| Ceftizoxima | fl 250 mg im, fl 500 mg im, fl 1g im, fl 1g ev, fl 2g ev | Adulti: 1-4 g/die suddivisi in 2 somministrazioni Bambini: 30-100 mg/Kg/die suddivisi in 2-4 somministrazioni |
| Cefoperazone | fl 250 mg im, fl 500 mg im, fl 1g im, fl 2g im, fl 1g ev, fl 2g ev | Adulti: 1-4 g/die suddivisi in 2 somministrazioni Bambini: 25-100 mg/Kg/die suddivisi in 2 somministrazioni |
| Ceftazidima | fl 250 mg im, fl 500 mg im, fl 1g im, fl 1g ev, fl 2g ev | im: Adulti: 1-3 g/die suddivisi in 2-3 somministrazioni Bambini: 30-100 mg/Kg/die suddivisi in 2-3 somministrazioni; ev: Adulti: 1-6 g/die. Bambini: 30-100 mg/kg/die |
| Ceftriaxone | fl 250 mg im, fl500 mg im, fl 1g im, fl 1g ev, fl 2g ev | Adulti: 1 g/die in monosomministrazione Bambini: 20-80 mg/Kg/die in monosommistrazione |
| Latamoxef | fl 1g im, fl 2g ev | Adulti: 1g/die Bambini: 50 mg/Kg/die |
| Cefodizima | fl 1g im, fl 2g ev, fl 1g im/ev | Adulti: 1-2 g/die suddivisi in 1-2 somministrazioni |
| Cefepime | fl 500 mg im/ev, fl 1g im/ev | Adulti e bambini di età superiore a 12 anni: 2-4 g/die suddivisi in 2 somministrazioni. |
| Panipenem + | ||||
| Imipenem-cilastatina | betamepron | |||
| 1/1 | Meropenem | (BP) 1/1 | Biapenem | |
| Picchi sierici | Imipenem iv 500 mg 20-50; | 500 mg: 25 | 1000 mg: 41 | 500 mg: 25-30 |
| (µg/ml) | 1000 mg iv 40-80 | 1000 mg: 55 | 1000 mg: 55 | |
| Cilastatina 500 mg 31-50; | ||||
| 1000 mg 60-88; | ||||
| Imipenem im 1500 mg 10; | ||||
| 750 mg 12 | ||||
| Emivita plasmatica(h) | Imipenem: 1 | 1 | 1 | 1.2 |
| Cilastatina: 3-6 | ||||
| AUC | 40 | 500 mg: 30 | 45 | 500 mg: 25 |
| 1000 mg: 55-60 | 1000 mg: 48 | |||
| Legame con le proteine | Imipenem: 20%; | < 10% | 10-20% | |
| plasmatiche | Cilastatina: 40% | |||
| Volume di distribuzione | 12 l/h | 20 l/h | 12 l/h | 12-15 l/h |
| (0.2 l/kg) | (0.4 l/kg) | (0.2 l/kg) | (0.2 l/kg) | |
| Biotrasformazione | Intensa (70% senza cilastatina, | Scarsa (20%) | - | Scarsa (25%) |
| metabolica | 30% con cilastatina) | |||
| Clearance totale | 200-250 ml/min | 280 ml/min | Panipenem | 10.3 |
| 12 l/h imipenem | 15 l/h | 2 l/h | ||
| 170-200 ml/min cilastatina | BP 23 l/h | |||
| Clearance renale | 130-150 ml/min | 180-230 ml/min | 2.5 l/h | |
| Elimi. urinaria | 70% | 65-70% | Panipenem 30% BP | 65% |
| (24 h) | 95% | |||
| Capacità di dialisi | Molto dializzabili: 80% | Molto dializzabile | ||
| imipenem, 60% cilastatina | ||||
| Eliminazione G, T | G 85%, T 15% (imipenem) | G+T (predominante) | BP: G+T | |
| G 20%, T 80% (cilastatina) | (predominante) |
G= filtrazione glomerulare; T= secrezione tubulare.
| Altri anti-infettivi o altri farmaci | Effetti ottenuti | Meccanismo | Germi interessati o indicazioni principali |
|---|---|---|---|
| Aminosidi | Sinergia antibatterica + inibizione delle potenziali resistenze | Aumento da parte dei carbapenemi della permeabilità della parete batterica permettendo un migliore accesso dell’aminoside sui bersagli batterici. Allungamento dell’effetto post-antibiotico | Stafilococco, enterococco, Pseudomonas, Acinetobacter, enterobatteri grandi produttori di cefalosporinasi di classe I (mutanti attivati) |
| Glicopepetidi | Sinergia antibatterica + inibizione delle resistenze batteriche e delle sovraninfezioni | Inibizione sequenziale della sintesi della parete batterica | Stafilococco, enterocco, pneumococco penicillinoresistente, anaerobi |
| Sulbactam | Addizione dell’attività | Acinetobacter | |
| antibatterica su | |||
| Acinetobacter | |||
| Fosfomicina | Effetto additivo o sinergico sugli staf. meti-R e gli Pseudomonas | Inibizione sequenziale della sintesi della parete batterica + inibizione della sintesi della PBP2a da parte della fosfomicina | Staf. Meti-R, Pseudomonas, enterobatteri |
| Rifampicina | Effetto sinergico antibatterico + inibizione delle resistenze batteriche | Azione su bersagli batterici differenti: inibizione della sintesi della parete batterica (carbapenemi), azione sull’RNA batterico (rifampicina) | Staf. Meti-R, penumococco resistente alle penicilline, enterobatteri, Pseudomonas |
| Polimixina-colistina | Effetto sinergico antibatterico (Pseudomonas) + inibizione delle resistenze batteriche | Azione su bersagli batterici differenti: parete batterica (carbapenemi), membrana batterica (polimixina, colistina) | Pseudomonas, Acinetobacter Enterobatteri |
| Acido fusidico | Sinergia + inibizione delle resistenze batteriche | Azione su bersagli batterici differenti: inibizione della | Staf. meti-R, anaerobi |
| parete batterica (carbapenemi), inibizione della sintesi delle | |||
| proteine batteriche (acido fusidico) | |||
| Probenecid | Aumento dei tassi sierici e nel LCR della emivita dei | Competizione sulla secrezione tubulare renale | Meningiti Endocarditi |
| carbapenemi eliminati principalmente per secrezione tubulare | |||
| (meropenem) | |||
| Fluorochinoloni | Sinergia + inibizione delle resistenze batteriche | Azione su bersagli batterici differenti: sulla DNA-girasi (fluorochinoloni), inibizione della sintesi della parete batterica: carbapenemi | Pseudomonas aeruginosa, Serratia, Enterobacter |
* I carbapenemi sono utilizzati più spesso in monoterapia ad eccezione che nelle infezioni sostenute da alcuni germi difficili: staf. meti-R, enterococchi, Pseudomonas, Acinetobacter.
| Metodo | |||||
| Altri antibiotici | di prevenzione | Condotta | |||
| o farmaci | Tipo di rischio | Fattori favorenti | Meccanismo | o correzione | da adottare |
| Beta-lattamine | Rischio di scacco | Infezioni da grandi | Induzione delle | Da evitare | |
| idrolizzate dalle | terapeutico e di | popolazioni batteriche | beta-lattamasi da | ||
| beta-lattamasi: | sovrainfezioni da | (eccesso di beta- | parte dei | ||
| carbossi ed | germi resistenti | lattamasi): | carbapenemi, | ||
| ureidopenicilline, | endocarditi, meningiti, | potenti induttori, | |||
| cef3, penicilline | infezioni urinarie, | inattivanti le beta | |||
| antistafilococciche, | ascessi profondi | lattamine | |||
| aztreonam | idrolizzate dalle | ||||
| beta-lattamasi | |||||
| Altri medicamenti | Rischio aumentato | Dosi elevate, | Aumento della | Sorveglianza della | Precauzioni |
| neurotossici: | di convulsioni | insufficienza renale | neurotossicità | neurotossicità | di impiego |
| ganciclovir, | |||||
| nitroimidazolo, | |||||
| ciclosporine |
torna su vai all'Home Page vai all'indice antibioticoterapia
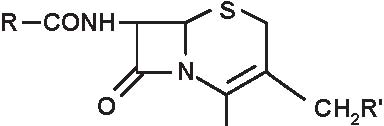
 CH
S
CH
S