Aminoglicosidi e Aminociclitoli
Generalità
Malgrado tutti gli sforzi compiuti per rimpiazzare gli aminosidi a causa dei loro reali inconvenienti (margine tera-peutico ristretto, nefro- ed ototossicità, necessità di un frequente monitoraggio dei loro tassi sierici, necessità di somministrazione parenterale) e malgrado la disponibilità di nuove beta-lattamine molto potenti (penicilline a spettro molto ampio, cefalosporine di terza e quarta generazione, monobattami, imipenem, etc.), gli aminosidi rimangono sempre indispensabili e continuano ed essere impiegati, soprattutto in ambiente ospedaliero, nel tratta-mento delle gravi infezioni, in associazione ad un secondo antibiotico, più spesso una beta-lattamina, grazie alle loro caratteristiche antibatteriche: azione battericida potente e rapida, effetto post-antibiotico, assenza di effetto inoculo, frequente sinergia con le beta-lattamine.
Composizione chimica ed origine
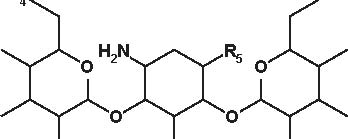
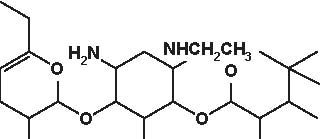
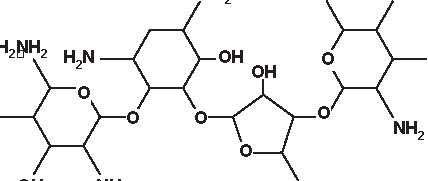
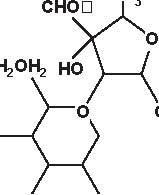
Secondo la loro origine gli aminosidi attuali vengono estratti:-da uno Streptomyces: streptomicina, kanamicina, neomicina, tobramicina, paromomicina , spectinomicina-da una Micromonospora: gentamicina , sisomicina, netilmicina, sagamicina, fortimicina (astromicina), dactinomicina.Infine, un certo numero di aminosidi viene ottenuto per semisintesi:-Amikacina, ottenuta a partire dalla kanamicina A-Dibekacina, ottenuta a partire dalla tobramicina-Abekacina, ottenuta a partire dalla dibekacina-Netilmicina, ottenuta a partire dalla sisomicina-Sagamicina, ottenuta a partire dalla gentamicina C-Isepamicina, ottenuta a partire dalla gentamicina B-Trospectomicina, ottenuta a partire dalla spectinomicina (6’- propil-spectinomicina)-Dactinomicina, ottenuta a partire dall’astromicina (2’’-N-formimidol-astromicina).Alcuni aminosidi utilizzati in passato in alcune Nazioni, non sono stati più utilizzati; si tratta di ribostamicina,lividomicina, kanendomicina (bekanamicina) e kanamicina (Tabella 4.1).Gli aminosidi sono costituiti da due (la grande maggioranza di essi) o da tre aminozuccheri, legati tramite unlegame glicosidico ad un nucleo centrale costituito da un esoso (aminociclitolo); solamente la spectinomicina e latrospectinomicina non presentano aminozuccheri legati all’aminociclitolo (aminociclitoli “puri”).Secondo il nucleo centrale (aminociclitolo) si distinguono tre gruppi di aminosidi:-Aminosidi aventi come nucleo centrale una streptidina: streptomicina, diidrostreptomicina.-Aminosidi aventi come nucleo centrale aminociclitolo una 2-desossi-streptamina, che comporta 2 sottogruppi, a
seconda che gli zuccheri costituenti siano legati al nucleo desossistreptamina tramite degli atomi di carbonio adiacenti o no: 1) aminosidi che hanno una desossistreptamina sostituita su due atomi di carbonio adiacenti, in posizione 4 e 5
(neomicina, framicetina, paromomicina) ed un ribosio come zucchero.
2) aminoglicosidi che hanno una 2-desossistreptamina sostituita su due atomi di carbonio non adiacenti, in posizione 4 e 6 (kanamicina, gentamicina, tobramicina, amikacina, dibekacina, sisomicina, netilmicina, isepamicina, sagamicina).
-Aminosidi aventi come nucleo centrale N-formimidoil: dactimicina.Vi è un numero variabile di funzioni aminiche primarie e di funzioni idrossiliche.Vengono incluse nel gruppo degli aminosidi anche degli aminociclitoli “puri” quali la spectinomicina e latrospectinomicina. Questi aminociclitoli puri sono privi della nefro- e della ototossicità tipiche degli altri aminosidied hanno uno spettro antibatterico diverso e più ampio. Gli aminosidi a somministrazione sistemica sono tutte delledesossistreptamine sostituite in posizione 4-6 (Tabella 4.2; Figura 4.1).
Proprietà fisico-chimiche
Peso molecolare variabile, da 300 a 1000. Idrofilia ed idrosolubilità elevate. Carica polare policationica, che ne impedisce l’assorbimento gastroenterico; pKa 7.9-8.1; carattere basico. In terapia, per tutti gli aminosidi, si utilizza il solfato.
Meccanismo d’azione
Inibizione della sintesi proteica batterica per azione diretta sui ribosomi batterici (affinità selettiva), grazie al loro legame con la proteina S12 e con altri siti delle subunità 30 S dei ribosomi batterici; la conseguenza è la formazione di peptidi aberranti non funzionali, dovuti alla errata trascrizione dell’informazione contenuta nel RNA messaggero (errori di lettura) e ad inibizione della traslocazione. L’incorporazione di aminoacidi errati nella sequenza proteica in formazione e la dissociazione dei fosfolipidi della membrana citoplasmatica batterica comportano la fuoriuscita di potassio e di aminoacidi intracellulari, con lisi batterica rapida. Il passaggio transmembrana degli aminosidi all’interno dei batteri è un fenomeno attivo che richiede ossigeno e, per tale motivo, non può avvenire in anaerobiosi; ciò spiega la naturale resistenza della flora anaerobia agli aminosidi.
Spettro antibatterico e resistenze batteriche
Lo spettro antibatterico dei vari aminosidi è molto simile, ad eccezione della streptomicina e, soprattutto, della spectinomicina-trospectinomicina. Lo spettro della maggior parte degli aminosidi comprende enterobatteri, Francisella, Pasteurella, Yersinia, Brucella, Pseudomonas, Acinetobacter ed i seguenti bacilli Gram positivi: Corynebacterium jeikeium, Erysipelothrix, Listeria, stafilococchi meticillino-sensibili. Gli stafilococchi meticillino-resistenti sono, attualmente, molto spesso resistenti agli aminoglicosidi: in Francia si ha il 90% di resistenza alla gentamicina e suoi succedanei ed il 70% di resistenza ad amikacina e netilmicina. Lo Pseudomonas non è sensibile né alla kanamicina, né agli aminociclitoli, né alla paromomicina e la percentuale delle resistenze attuali è in crescendo secondo il seguente schema: amikacina = abekacina > netilmicina > tobramicina > sisomicina > gentamicina. Patogeni resistenti sono: streptococchi- pneumococchi (ad eccezione della trospectinomicina)- enterococchi (ma questi ultimi sono sensibili all’associazione aminoside + beta-lattamina), anerobi (Bacteroides è sensibile alla trospectinomicina), spirochete, Chlamydia, Mycoplasma (questi ultimi due sono sensibili alla trospectinomicina), Legionella, Nocardia (ad eccezione dell’amikacina per quest’ultimo), Providencia (naturalmente resistente grazie ad una acetilasi AAC 2’ cromosomica di supporto). Neisseria, Haemophilus e Gardnerella vaginalis sono poco sensibili agli aminosidi, ad eccezione della spectinomicina-trospectinomicina. La paromomicina include inoltre nel suo spettro Entamoeba histolytica, Taenia e Giardia lamblia. Infine, streptomicina, kanamicina, amikacina ed isepamicina sono dotate di azione sui micobatteri (batteri tuberco-lari extracellulari in fase di attiva moltiplicazione, a pH neutro o alcalino) e sul Mycobacterium avium intracellulare (MAC); sono invece inattive sui bacilli tubercolari delle lesioni caseose acide. L’amikacina è più attiva su Enterobacter, Serratia, Citrobacter e Nocardia asteroides. Gli aminociclitoli “puri” (spectinomicina e, soprattutto, trospectinomicina) hanno uno spettro d’azione più ampio che comprende anche Neisseria, Haemophilus influenzae, Haemophilus ducrey, Branhamella catarrhalis, cocchi Gram positivi (compresi streptococchi, pneumococchi, enterococchi), anaerobi Gram positivi e Gram negativi, treponemi ed anche (almeno in vitro) alcuni germi intracellulari privi di parete, quali Chlamydia, Mycoplasma ed Ureaplasma. Patogeni resistenti agli aminoniciclitoli sono gli stafilococchi meticillino-resistenti, Pseudomonas aeruginosa ed i treponemi. Al momento attuale, tenendo conto delle resistenze batteriche sviluppate negli ultimi anni, si può considerare che gli aminosidi con lo spettro antibatterico più ampio e le minori resistenze batteriche sono l’isepamicina, l’amikacina, l’abekacina e la netilmicina. Le differenze nello spettro antibatterico di gentamicina-sisomicina-dibekacina-tobramicina sono molto lievi. Le MIC per i patogeni sensibili sono di 1-15 µg/ml per streptomicina, kanamicina, dibekacina, 0.1-1 µg/ml per gentamicina, sisomicina, netilmicina, tobramicina, <8 µg/ml per la spectinomicina (gonococco), ≥16 µg/ml per la trospectinomicina. Presenza di effetto postantibiotico concentrazione-dipendente, contemporaneamente per i germi Gram positivi e Gram negativi. Assenza di effetto inoculum, il che consente agli aminosidi una buona attività nelle infezioni soste-nute da notevoli popolazioni batteriche. L’azione battericida è rapida e concentrazione-dipendente. L’azione antibatterica viene rinforzata da un ambiente alcalino (pH ottimale), mentre diminuisce in ambiente acido, in anaerobiosi ed in presenza di una concentrazione elevata (come nelle urine) di ioni Ca++ e Mg++, oltre che per azione delle ribonucleoproteine derivanti dal disfacimento dei leucociti (pus).
KANAMICINA AMIKACINA
 R4
OH H
R4
OH H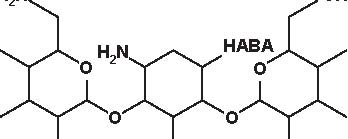 2N
OH R3
2N
OH R3
OH OH
OH
NH2 R1 OHOH OHOHOH
TOBRAMICINA GENTAMICINA
NH2 OH
R2 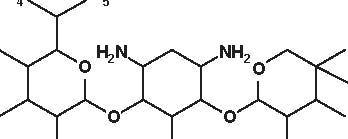 R4
R5
R4
R5
H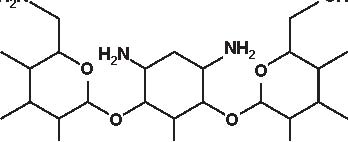 2N
OH
2N
OH
R3
R6OH
OH OH
R2
NHCH3H
NH2
R1 OHOH NH2 OH OH
NETILMICINA PAROMOMICINA
H2N 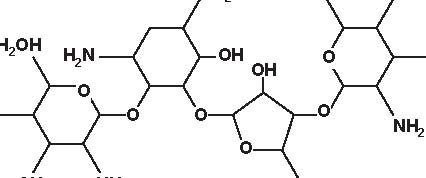 NH2
CH2NH2 OH
NH2
CH2NH2 OH
 H2CH3
CH2
H2CH3
CH2
OH OH
NHCH3 OH
NH2 OH OH OH NH2 CH2OH NEOMICINA STREPTOMICINA
 NH2
CH2NH2 OH
NH2
CH2NH2 OH
NH
 CH3
CH3
CHO
CH2
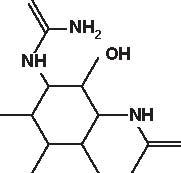 NH2OH
NH2OH
NH OH CH2OH2 HO
OH O HO
NH OH NH2 CH2OH
OH OH NH2 OH NHCH3
TROSPECTINOMICINA
OH
H
N
OO
O
CH3
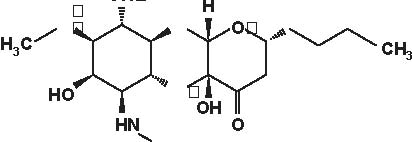
Figura 4.1 Alcune formule di struttura degli aminoglicosidi e aminociclitoli.
Resistenze batteriche
Le resistenze batteriche agli aminosidi sono in netto aumento, soprattutto per alcuni batteri. Sono stati segnalati tre meccanismi di resistenza, di differente importanza:
1. Resistenza da inattivazione degli aminosidi da parte di enzimi batterici
Rappresenta il meccanismo più frequente ed importante di resistenza agli
aminosidi. Esso consiste nell’inattivazio-ne degli aminosidi da parte di
enzimi batterici codificati da plasmidi o trasposoni localizzati nello
spazio periplasmaticodei batteri (resistenza extracromosomica); questo tipo
di resistenza è trasferibile e spesso multipla. Sono statelocalizzate tre
categorie di enzimi:-Adeniltransferasi (AAD) o nucleotidiltransferasi (ANT),
che fissano un radicale adenil su un gruppo idrossile (OH).-Fosfotransferasi
(APH), che fissa un radicale fosforil su un gruppo idrossile
(OH).-Acetiltransferasi (AAC), che fissa un radicale acetile su un gruppo NH2.
Ognuna di queste tre categorie di enzimi comprende diversi sottotipi
(Tabella 4.3).
Lo stesso enzima è in grado di inattivare molti aminosidi. La soppressione
del sito d’inattivazione enzimatica
(dibekacina) o la protezione del sito enzimatico mediante un radicale
2-idrossi-4 aminobutirril (amikacina, abekacina)
o mediante altri radicali (netilmicina, isepamicina, sagamicina), permette a questi aminosidi una migliore resistenza all’inattivazione enzimatica. Attualmente, gli aminosidi più resistenti all’inattivazione enzimatica sono in ordine decrescente l’isepamicina, l’amikacina, l’abekacina e la netilmicina. Gli enzimi inattivanti attaccano diversi siti di differenti aminosidi; ciò spiega la loro resistenza spesso crociata. Ad esempio, la kanamicina B possiede 7 siti sensibili all’inattivazione (idrossi o amino), la tobramicina 5 siti, la gentamicina e la dibekacina 4 siti, l’amikacina e l’abekacina solamente 2 siti. Si notino le differenze con l’inattivazione enzimatica delle beta-lattamine, nelle quali esiste una sola categoria di enzimi inattivanti (le beta-lattamasi) che attaccano un unico sito, costituito dall’anello beta-lattamico, idrolizzandolo. Gli enzimi inattivanti degli aminosidi non distruggono l’antibiotico, ma ne impediscono l’accesso al sito ribosomiale d’attacco. Infine, a tutt’oggi, non esistono ancora inibitori degli enzimi inattivanti gli aminosidi, come invece accade per le beta-lattamine.
2. Resistenza per difetto di fissazione dell’aminoside al sito d’attacco ribosomale (resistenza ribosomale)
Questo meccanismo di resistenza si riscontra con gli aminosidi aventi nucleo streptidinico (streptomicina). Essa èdovuta ad una mutazione. Il mutante non possiede più la proteina specifica della subunità 30S del ribosoma.Questo tipo di resistenza è raro, ma di livello molto elevato e spiega la resistenza di alcuni enterococchi all’associa-zione penicillina G + streptomicina (blocco della sinergia).Essa non si verifica con gli aminosidi ad anello 2-desossistreptaminico.Recentemente sono stati trovati dei ceppi di enterococco con resistenza ad alto livello anche alla gentamicina (masi tratta di resistenza enzimatica d’origine plasmidica).Questa resistenza acqusita degli enterococchi, di livello molto alto (MIC >1000 µg/ml), si distingue dalla resistenzanaturale di questi microrganismi, che è di basso livello (MIC = 4-16 µg/ml).
3. Resistenza per difetto di penetrazione dell’aminoside nella parete della cellula batterica (impermeabilità)
Questo tipo di resistenza si verifica per mutazione cromosomica (es. Pseudomonas) o per difetto dei meccanismi di trasporto transmembrana (assenza del trasporto transmembrana), come avviene, ad esempio, per la resistenza degli anaerobi. L’attuale situazione della resistenza agli aminosidi dipende da vari fattori: il microrganismo in causa, l’ospedale, il paese, nonché “l’anzianità d’uso” del singolo aminoside.
Farmacodinamica e farmacocinetica
La farmacocinetica di tutti gli aminosidi è molto simile ed omogenea: essa è di tipo lineare, cioè i tassi sierici, l’AUC e la clearance (totale e renale) aumentano proporzionalmente alle dosi somministrate. Assenza di assorbimento gastroenterico dopo somministrazione orale (salvo in caso di anastomosi porto-cavale o di colite ulcerosa). I picchi sierici ammontano a circa quattro volte la dose iniettata (in µg/g) per la gentamicina e suoi succedanei (4-5 µg/ml dopo 75-80 mg), di circa tre volte per l’amikacina (20-25 µg/ml dopo 500 mg), di circa 100 µg/ml per la streptomicina (dopo 2 g), di 30-80 µg/ml per la spectinomicina (dopo 1 g). Tuttavia, questi picchi sierici possono variare in funzione di molti fattori: età, funzione renale, obesità, presenza di ascite, etc.; tali motivi impongono spesso il dosaggio dei tassi sierici in alcune situazioni, al fine di evitare dei tassi plasmatici infraterapeutici o, al contrario, tossici. Nei neonati l’assorbimento è più rapido, il VD più elevato, l’eliminazione renale più lenta. L’emivita è di circa 2-2.5 ore. Il legame alle proteine plasmatiche è molto debole: < 30% per la streptomicina, < 5% per gli altri aminosidi. Assenza di biotrasformazione metabolica. La diffusione nei tessuti è scarsa, limitata esclusi-vamente ai fluidi extracellulari, con un volume di distribuzione di 14-20 l. I tassi tessutali sono inferiori ai tassi sierici, ad eccezione della corteccia renale.
Debole diffusione nel liquor, nel pus (ove gli aminosidi sono inattivi a causa del pH acido), nella prostata, nelle secrezioni bronchiali, nell’umor acqueo e nella bile. Per contro, si ha una buona concentrazione nel liquido sinoviale e nell’ascite, con tassi equivalenti ai tassi sierici. Si verifica passaggio attraverso la barriera placentare, con accu-mulo nel liquido amniotico. Eliminazione rapida essenzialmente renale (80-90% in 24 h) sotto forma attiva, per esclusiva filtrazione glomerulare. I tassi urinari sono elevati, superiori di molto ai tassi sierici: 100-300 µg/ml per la gentamicina ed i suoi succedanei, 100-800 µg/ml per l’amikacina. La clearance renale è simile alla clearance della creatinina (80-120 ml/min). Gli aminosidi sono dializzabili. Il margine terapeutico è ristretto e si trova tra concen-trazioni subottimali e concentrazioni tossiche (nefro- ed ototossiche). Si segnala, infine, che gli aminosidi somministrati per via orale (neomicina) esplicano un effetto ipocolesterolemiz-zante, dovuto all’aumento dell’escrezione del colesterolo fecale.
Tossicità ed effetti indesiderati
Gli effetti indesiderati degli aminosidi sono costituiti prevalentemente dalla nefro- e dalla ototossicità.
Nefrotossicità
Essa è di tipo dose-dipendente ed è dovuta all’accumulo degli aminosidi nella corteccia renale a livello delle cellule tubulari, ove raggiungono delle concentrazioni pari a 50-100 volte i tassi sierici, con delle emivite molto prolungate, comportando una perturbazione del metabolismo dei fosfolipidi tubulari. La nefrotossicità è dovuta alla successione di tutta una serie di eventi, di seguito descritti, denominati “cascata di Tulkens”. Dopo l’eliminazione dell’aminoside per filtrazione glomerulare, si ha la successiva fissazione sulla membrana a spazzola della cellula tubulare e, conse-cutivamente, il sequestro e la concentrazione nei lisosomi del tubulo prossimale. Eventi precoci (da 0 a 6 giorni): -accumulo di fosfolipidi nei lisosomi, che aumentano di volume -inibizione dell’attività delle fosfolipasi e delle sfingomielinasi lisosomiali -diminuzione del riassorbimento, sequestro lisosomiale intracellulare e digestione delle proteine esogene cationiche
(lisozima, β2-microglobulina) -liberazione degli enzimi della membrana a spazzola (alanilaminopeptidasi) e degli enzimi lisosomiali (N-acetil
beta-glucosaminidasi) Eventi più tardivi (dopo 6 giorni) a) eventi degenerativi: -aumento dell’escrezione urinaria dei fosfolipidi (corpi mieloidi) -proteinuria, poliuria ipoosmolare -diminuzione della filtrazione glomerulare ed aumento della ritenzione azotata b) eventi rigenerativi: -proliferazione delle cellule tubulari -dilatazione tubulare -proliferazioni interstiziale fibroblastica ed infiltrazione focale da parte di cellule infiammatorie. L’accumulo tubulare (sequestro) degli aminosidi si compie di preferenza all’interno dei lisosomi, dei mitocondri ed a livello dell’orletto a spazzola della membrana delle cellule tubulari, laddove essi interferiscono con il metabolismo dei fosfolipidi, per inibizione delle fosfolipasi e delle sfingomielinasi. I cationi bivalenti (Ca++, Mg++) inibiscono per competizione la fissazione degli aminosidi ai lisosomi; le modificazioni morfologiche di questa fissazione si traducono nell’aumento di volume dei lisosomi, con formazione al loro interno di corpi mieloidi (fosfolipidosi renale). L’effetto biologico consiste nella liberazione e nell’eliminazione urinaria degli enzimi lisosomali (NAG, n-acetyl-beta-D-glucosaminidasi, sfingomielinasi), di enzimi dell’orletto a spazzola (alanina-aminopeptidasi), oltre che di β2-microglobulina. Un pò più tardi si producono delle lesioni degenerative: necrosi focale, granulazione delle cel-lule epiteliali, aumento dell’escrezione urinaria di fosfolipidi, proteinuria, poliuria ipoosmotica, aumento della cre-atininemia. Congiuntamente appaiono lesioni riparative: proliferazione e dilatazione delle cellule tubulari, prolife-razione fibroblastica interstiziale ed infiltrazioni focali di cellule infiammatorie (nefrite tubulo-interstiziale). Il quadro clinico è variabile, talvolta latente o discreto, senza modificazioni della diuresi, ma con aumento della creatininemia e dell’enzimuria; è raro che si verifichi un’insufficienza renale acuta per necrosi tubulare. La nefrotossicità diminuisce progressivamente nel seguente ordine: neomicina < kanamicina < gentamicina < tobramicina < amikacina < netilmicina< dactinomicina < streptomicina < spectinomicina (la meno nefrotossica). Fattori favorenti la nefrotossicità sono costituiti dall’età > 60 anni, da trattamenti prolungati a dosi elevate (tassi sierici > 10 µg/ml per la gentamicina e i suoi succedanei), da preesistente insufficienza renale, dall’insufficienza epatica, dalle modalità di somministrazione (la monosomministrazione giornaliera è meno nefrotossica rispetto alle multiple somministrazioni giornaliere), dall’ipovolemia da deplezione salina (diuretici, regimi iposodici), dall’asso-ciazione con altri antibiotici nefrotossici (alcune cefalosporine, amfotericina B, polimixina-colistina, vancomicina, acyclovir) o con altri farmaci nefrotossici (metossiflurano, cisplatino, ciclosporina, FANS, etc.). Per la prevenzione, o almeno per la riduzione degli effetti nefrotossici, sono stati proposti diversi mezzi: utilizzo di cationi (Ca++) per inibire competitivamente la fissazione degli aminosidi alla membrana delle cellule tubulari (sequestrazione); asso-ciazione alla fosfomicina o alla piperacillina che sembrano esercitare un effetto protettivo sulla membrana lisosomiale delle cellule tubulari; la somministrazione di un calcioantagonista (ad esempio il diltiazem); la somministrazione dell’aminoside in monosomministrazione quotidiana (perché la nefrotossicità non è dovuta ai valori di picco sierico, quanto piuttosto a quelli di valle ed all’AUC); ma, soprattutto, il monitoraggio dei picchi sierici e dei tassi residui, oltre che della creatininemia, nei soggetti a rischio: picchi < 10 mcg/ml per la gentamicina ed i suoi succedanei, picchi < 30 mcg/ml per l’amikacina, tassi residui > 2 mcg/ml.
Ototossicità
L’ototossicità cocleovestibolare degli aminosidi può essere a predominanza vestibolare (streptomicina, dibekacina)
o a predominanza cocleare (neomicina, kanamicina, amikacina). Tra gli attuali aminosidi, la neomicina sembra essere la meno ototossica. Il meccanismo dell’ototossicità è meno conosciuto rispetto a quello della nefrotossicità; il meccanismo che ipotizzava l’accumulo nella perilinfa, accettato tempo fa, non è stato poi confermato dagli studi recenti. Istologicamente, vengono successivamente colpite, dalla base verso l’apice, le cellule sensoriali ciliate esterne, poi le cellule ciliate interne dell’organo del Corti. Si notano alterazioni delle stereociglia. Il meccanismo general-mente accettato è il legame dell’aminoside ai fosfolipidi (fosfaditil inositolo) della membrana cellulare. Le manifestazioni cliniche della tossicità cocleare sono: acufeni, ipoacusia. L’ipoacusia si manifesta all’inizio per le frequenze alte; per tale motivo essa non può essere avvertita dal paziente prima che di avere colpito le frequenze tipiche della conversazione, ma viene avvertita per frequenze sopraconversazionali (> 8000 Hz). La tossicità cocleare può progredire anche dopo la sospensione del trattamento; essa è irreversibile. Il rischio cocleare è particolarmente elevato in caso di instillazione intrauricolare di aminosidi in caso di perforazione timpanica o in caso di assorbimen-to intestinale in corso di somministrazione orale (neomicina, paromomicina) in soggetti con anastomosi porto-cavali o con colite ulcerosa o in caso di trattamento di encefalopatia epatica acuta con neomicina per via orale. Le manifestazioni della tossicità vestibolare si riducono a disturbi dell’equilibrio: vertigini, nistagmo, sensazioni rotatorie, nausea, atassia. L’elettronistagmogramma mostra iporeflessività alle prove caloriche. In generale, una efficace com-pensazione centrale si stabilisce in poche settimane ed i sintomi regrediscono, soprattutto nei soggetti giovani. I disturbi vestibolari sono più precoci rispetto a quelli cocleari e sono parzialmente reversibili, per compensazione centrale, mentre quelli cocleari sono più tardivi ed irreversibili. Fattori favorenti l’ototossicità sono rappresentati dall’età (neonati, prematuri e soggetti anziani), dai soggetti portatori di una mutazione 1555G, da dosi elevate e trattamenti prolungati (> 10 giorni), dall’insufficienza renale, da tassi sierici residui > 2 µg/ml, da cure ripetute, ipovolemia e diuretici dell’ansa, dalla somministrazione intrarachidea, intrauricolare (in caso di perforazione timpanica) ed in caso di lesioni auricolari precedenti, dall’etilismo (che favorisce i disturbi auricolari), dall’insufficienza epatica, dall’associazione con altri farmaci ed antibiotici ototossici. I mezzi per controllare e correggere l’ototossicità preve-dono il monitoraggio dei tassi sierici (soprattutto quelli residui; 1-2 mg/l per la gentamicina ed i suoi succedanei, 3-7 mg/l per l’amikacina), della funzionalità renale (creatininemia), dell’audiometria e dell’elettronistamografia (so-prattutto in caso trattamenti prolungati), nonché l’eliminazione delle bevande alcoliche, la somministrazione dell’aminoside preferibilmente di sera, in monosomministrazione giornaliera (in tal modo si ha un picco elevato ma di breve durata e la perilinfa non ha il tempo di saturarsi), e l’apporto supplementare di Ca++.
Blocco neuromuscolare
Può essere provocato soprattutto dopo somministrazione locale intraperitoneale (neomicina). Il meccanismo consi-ste nell’inibizione della liberazione dell’acetilcolina a livello pre- o post-sinaptico. Le manifestazioni cliniche consi-stono in una depressione respiratoria, che può giungere sino all’apnea, ed in un aggravamento o una slatentizzazione di una miastenia. Fattori favorenti sono rappresentati dagli anestetici generali, dai curarici e miorilassanti, dall’in-sufficienza renale, da dosi elevate, da ipocalcemia, ipomagnesiemia oltre che dalla somministrazione intraperitoneale. Mezzi di controllo e di correzione sono rappresentati dalla somministrazione di Ca++ iv, di anticolinesterasici (prostigmina), nonché da misure di assistenza respiratoria.
Altri effetti collaterali
Per via orale, gli aminosidi (neomicina, kanamicina, paromomicina) somministrati a dosaggi elevati e per periodi prolungati, come nel caso della terapia degli stati iperammoniemici in corso di encefalopatie porto-cavali, possono provocare una sindrome da malassorbimento con steatorrea, a causa dell’atrofia villosa da essi causata. Una anosmia, parziale o totale, è stata segnalata in corso di trattamenti prolungati con streptomicina. Di contro, le reazioni allergiche sono particolarmente rare con gli aminosidi, i quali sono ritenuti molto poco allergizzanti, salvo in caso di uso topico prolungato (neomicina).
Indicazioni cliniche
Gli aminosidi vengono utilizzati maggiormente in ambiente ospedaliero. Nella pratica extra-ospedaliera, le indicazioni cliniche sono rare, eccetto che per la spectinomicina (2g) nel tratta-mento delle gonococcie resistenti alle beta-lattamine e nei soggetti allergici alle beta-lattamine. L’iniezione unica di gentamicina o dei suoi succedanei può essere giustificata in alcune particolari circostanze, quali, ad esempio, una infezione delle vie urinarie sostenuta da un patogeno resistente agli altri antibiotici, un’infezione urinaria recidi-vante causata da un’ostruzione, o nei portatori di un catetere permanente che presentino segni di infezione. Nella pratica ospedaliera gli aminosidi vengono impiegati soprattutto nel trattamento delle infezioni nosocomiali e quasi sempre in associazione con un secondo antibiotico. L’impiego del solo aminoside può essere giustificato nel trattamento delle infezioni delle alte vie urinarie, in caso di germi resistenti ad altri antibiotici meno tossici, nei soggetti giovani e quando si tratti di infezione urinaria recidivante ostruttiva, oppure nei portatori di catetere a permanenza, ed anche in caso di controindicazione all’uso delle beta-lattamine, a condizione che il microrganismo sia sensibile all’aminoside e che non si tratti di uno Pseudomonas o di un Acinetobacter. Va ricordato, inoltre, il trattamento delle gonococcie resistenti alle beta-lattamine (spectinomicina), nonché il trattamento della peste e della tularemia con la sola streptomicina. Infine, va menzionato il trattamento con la paromomicina per via orale per la teniasi, per la giardiasi e per le criptosporidiosi dell’apparato gastroenterico. Per tutte le altre seguenti indicazioni, l’aminoside deve essere impiegato in associazione con un altro antibiotico, di solito una beta-lattamina. Trattamento delle setticemie e delle endocarditi da streptococco–enterococco o da bacilli Gram negativi. Nelle endocarditi da streptococco sensibile alla penicillina G (MIC < 0.1 µg/ml), il trattamento con penicillina G (da preferire all’ampicillina a causa di uno spettro più ristretto, di una migliore tolleranza e di un minore costo) + streptomicina o gentamicina per 15 giorni può sostituire il trattamento con la sola penicillina G per 3–4 settimane. Di contro, per il trattamento delle endocarditi da enterococco, l’associazione penicillina G o ampicillina con un aminoglicoside (streptomicina o, in caso di resistenza di alto livello alla streptomicina – MIC > 2000 µg/ml-, gentamicina o suoi succedanei) è obbligatoria per tutta la durata del trattamento (di trenta giorni). Il dosaggio prevede 1 mg/kg ogni otto ore (dosaggi inferiori a quelli usati per le infezioni da bacilli Gram negativi). Prima di iniziare il trattamento, occorre verificare il livello di resistenza agli aminosidi, al fine di scegliere un aminoside con basso livello di resistenze. Attualmente, circa il 10% dei ceppi di Enterococcus faecalis presenta un alto livello di resistenza alla gentamicina. Nei soggetti allergici alle penicilline (o in caso di intolleranza alle stesse), si può ricorrere all’associazione aminoside
+ vancomicina (o teicoplanina). Per le infezioni da Pseudomonas o Acinetobacter bisogna ricorrere all’associazionedi una beta-lattamina anti Pseudomonas (penicillina o cefalosporina anti Pseudomonas, aztreonam) con unaaminoside (amikacina, netilmicina).Per le setticemie e le endocarditi da stafilococchi si ricorre all’associazione penicillina antistafilococcica o cefalo-sporina antistafilococcica di prima generazione con un aminoside (gentamicina e suoi succedanei). In caso distafilococchi meticillino-resistenti, si deve ricorrere a delle associazioni gentamicina + vancomicina + rifampicina,soprattutto in caso di endocarditi da Staphylococcus epidermidis su protesi valvolari che si manifestano nei soggettitossicodipendenti.Raccomandazioni per l’uso degli aminosidi nelle infezioni da enterococchi.La sinergia beta-lattamina – aminoside si osserva fin tanto che le MIC sono < 100 µg/ml. In caso d’infezione severa,richiedere la ricerca della presenza di un alto livello di resistenza alla streptomicina, alla kanamicina ed allagentamicina.In caso di resistenza di alto livello alla streptomicina, utilizzare la gentamicina o i suoi succedanei.In caso di resistenza di alto livello alla kanamicina, evitare questo farmaco ed anche l’amikacina nell’associazionecon una beta-lattamina o con un glicopeptide.In caso di resistenza di alto livello alla gentamicina, non è impiegabile alcun aminoside, salvo la streptomicina.In caso di infezione da Enterococcus faecium, solamente la gentamicina e l’amikacina sono utilizzabili in associa-zione ad una penicillina.Trattamento empirico iniziale degli stati febbrili nei soggetti neutropenici; più spesso si ricorre all’associazione diuna beta-lattamina a spettro molto ampio (carbossi- o ureidopenicillina, cefalosporina di terza generazione, imipenem)con un aminoside.Trattamento delle setticemie di origine urinaria (enterobatteri, Pseudomonas); si ricorre all’associazione di unabeta-lattamina a largo spettro con un aminoside. Tuttavia, gli aminosidi non sono indicati né nel trattamento delleinfezioni delle basse vie urinarie non complicate (per le quali si dispone di numerosi antibiotici attivi per via orale),né nel trattamento delle prostatiti batteriche, dato che gli aminosidi non si diffondono all’interno del tessutoprostatico.
Trattamento delle infezioni polmonari nosocomiali da bacilli anaerobi Gram negativi (trattamento con l’associazio-ne beta-lattamina ad ampio spettro + aminoside) e dell’otite esterna maligna da Pseudomonas aeruginosa (aminoside in associazione con ciprofloxacina). Al contrario, le infezioni polmonari da pneumococco, Haemophilus influenzae e Legionella non costituiscono indicazioni per gli aminosidi. Trattamento delle meningiti batteriche da bacilli Gram negativi, da Listeria (dove le beta-lattamine da sole esplica-no solo effetto batteriostatico) o da stafilococchi. Il ruolo degli aminosidi in queste infezioni è modesto (salvo che per Pseudomonas – Acinetobacter ), data la loro scarsa diffusione nel liquor, nel quale non si trovano né fagociti, né immunoglobuline, né opsonine e che quindi è privo di difese battericide. Bisogna dunque somministrare l’aminoside direttamente per via intrarachidea o direttamente nei ventricoli cerebrali (con il reservoir di Omaya), al fine di assicurare concentrazioni attive. D’altronde, a causa delle grandi variazioni nelle concentrazioni liquorali ottenute con identiche posologie, bisogna, in corso di trattamento, dosare le concentrazioni ottenute ed il potere battericida del liquor nei confronti del microrganismo responsabile. Attualmente, nel trattamento delle meningiti da bacilli Gram negativi, gli aminosidi vengono spesso sostituiti con vantaggio dalle cefalosporine di terza generazione e dai monobattami. Tuttavia gli aminosidi rimangono impiegati in associazione ed in trattamento locale, soprattutto nel caso che il microrganismo in causa sia uno Pseudomonas, una Listeria o un germe multiresistente. Trattamento delle osteomieliti da bacilli Gram negativi (neonati, soggetti anziani); si ricorre più spesso all’associa-zione beta-lattamina ad ampio spettro + aminoside oppure aminoside + fluorochinolone. Profilassi e trattamento, in chirurgia addomino-pelvica, delle infezioni da flora mista (enterobatteri, Pseudomonas, enterococchi, anaerobi). Aminoside + antibiotico antianaerobi (ureidopenicilline, aminopenicilline + acido clavula-nico, cefamicina, nitroimidazolo, clindamicina). Tuttavia, in questa indicazione, l’associazione di due antibiotici, trova concorrenza nella monoterapia con imipenem
o amossicillina-clavulanato. Trattamento iniziale empirico di tutte le gravi infezioni prima dell’isolamento dei mi-crorganismi responsabili; in questi casi si ricorre di solito all’associazione beta-lattamina ad ampio spettro + aminoside,in competizione ad una monoterapia con imipenem.Trattamento della brucellosi: associazione streptomicina + tetraciclina; questa terapia è in competizione con l’asso-ciazione rifampicina + doxiciclina, attualmente preferita.Trattamento della listeriosi neuromeningea: ampicillina + gentamicina o amikacina.Gli aminosidi per via orale non trovano più nessuna indicazione nel trattamento delle infezioni batteriche gastroin-testinali, nelle quali essi possono anche favorire la selezione di microrganismi resistenti.Le loro sole indicazioni in ambito gastroenterico resta il trattamento dell’encefalopatia iperammoniemica da insuf-ficienza epatica, nella quale essi agiscono sopprimendo la flora intestinale ammonio-produttrice, e la proliferazionebatterica in corso di malattia di Whipple. In questi casi si utilizza di solito la neomicina in associazione al lattulosio.L’associazione dell’aminoside ad un secondo antibiotico è obbligatoria soprattutto nelle seguenti indicazioni:-Infezioni da Pseudomonas, Acinetobacter, enterococchi, staflilocochi meticillino-resistenti e Mycobacterium avium.-Infezioni nei soggetti immunocompromessi o leucopenici ed infezioni miste (aerobi-anaerobi).-Trattamento delle peritoniti quali complicazioni della dialisi ambulatoriale continua (in associazione con la
vancomicina); trattamento delle infezioni del liquido ascitico nei cirrotici. Ovviamente, prima di scegliere gli antibiotici da impiegare, bisogna accertarsi che i microrganismni responsabili siano ad essi sensibili. I vantaggi dell’associazione sono ben conosciuti: aumento della battericidia per effetto sinergico, ampliamento dello spettro antibatterico, prevenzione delle resistenze batteriche. Un problema ancora irrisolto riguarda la scelta tra i vari aminoglicosidi: l’impiego in prima intenzione di amikacina, netilmicina o abekacina invece di gentamicina o dei suoi succedanei può essere giustificabile allorquando sia in causa Pseudomonas, Providencia o Serratia, visto che in tali casi le percentuali di resistenza sono più elevate con questa seconda categoria di aminosidi, soprattutto nel caso di gravi infezioni verificatesi in reparti di terapia inten-siva, in gravi ustionati, etc. L’amikacina trova una indicazione preferenziale nel trattamento delle nocardiosi e delle micobatteriosi (in quest’ultimo caso sempre in associazione).
Controindicazioni
Allergie agli aminosidi, miastenia, grave insufficienza renale, ipoacusia preesistente.
Precauzioni d’uso
In caso d’insufficienza renale, adattare la posologia in funzione della clearance della creatinina. Sorvegliare, nei limiti del possibile, la funzionalità renale ed auditiva oltre che i tassi sierici. Evitare trattamenti ripetuti o prolungati soprattutto negli anziani ed in caso d’insufficienza epatica (cirrosi). La durata del trattamento deve essere la più breve possibile (meno di 10 giorni). Evitare la somministrazione degli aminosidi in gravidanza, oltre che nei neonati e nei bambini piccoli, a causa dell’impossibilità in questa età di una precoce individuazione dei danni all’apparato cocleovestibolare. Evitare l’associazione di ogni farmaco o prodotto oto- e nefrotossico, nonché dei diuretici molto potenti. Durante la terapia con aminosidi occorre ridurre allo stretto necessario l’esecuzione degli esami radiologici comportanti l’iniezione di mezzi di contrasto iodati.
Interazioni farmacologiche
Interazioni utili (Tabella 4.4)-Con le beta-lattamine anti-Pseudomonas ed anti-Acinetobacter: carbossipenicilline ed ureidopenicilline, cefalo-
sporine anti-Pseudomonas, aztreonam, imipenem. -Con le beta-lattamine antistafilococciche: penicilline antistafilococciche, cefalosporine di prima generazione. -Con la penicillina G o con le aminopenicilline (streptococchi, enterococchi): Penicillina G + streptomicina o, se vi
è una resistenza di tipo ribosomiale alla streptomicina (MIC > 1000 µg/ml), penicillina G + gentamicina. -Con le cefalosporine: Klebsiella, enterobatteri, Pseudomonas -Con i fluorochinoloni (enterobatteri, Pseudomonas), soprattutto allo scopo d’impedire lo sviluppo della resistenza
ai fluorochinolonici. -Con vancomicina-teicoplanina: stafilococchi meticillino-resistenti o tolleranti, Streptococcus faecalis, Strepto-coccus faecium, allergia alle beta-lattamine (endocarditi). -Con la fosfomicina: stafilococchi meticillino-resistenti, Pseudomonas; diminuzione della nefrotossicità degli
aminosidi. -Con la rifampicina: stafilococchi meticillino-resistenti, Brucella. -Con clindamicina o metronidazolo: infezioni miste da aerobi ed anaerobi. -Con gli alcalinizzanti urinari: pH ottimale favorevole (infezioni urinarie).
Interazioni da evitare (Tabella 4.5)-Con il cloramfenicolo o le tetracicline: antagonismo antibatterico, soprattuto nei soggetti immunodepressi.-Con meticillina, cefaloridina, polimixina-colistina, vancomicina: aumento della nefrotossicità.-Con una beta-lattamina somministrata nello stesso liquido di perfusione: inattivazione diretta dell’aminoside da
parte della beta-lattamina (perfusioni prolungate, insufficienza renale). Gli aminosidi maggiormente inattivati sono la gentamicina e la tobramicina, il meno inattivato è l’amikacina; le beta-lattamine più inattivanti sono le carbossipenicilline, le meno inattivanti sono le cafalosporine e l’azlocillina.
-Con i diuretici dell’ansa: aumento dell’ototossicità e della nefrotossicità.-Con i mezzi di contrasto radiologici: aumento della nefrotossicità.-Con i citostatici, gli antinfiammatori di sintesi, la ciclosporina, gli antipertensivi inibitori dell’enzima di conver-
sione dell’angiotensina (ACE inibitori): aumento della nefrotossicità -Con la tossina botulinica: rischio di incremento degli effetti della tossina. -Con gli anestetici generali e gli agenti curarizzanti: aumento del rischio di blocco neuromuscolare. -Con la digossina (per gli aminosidi a somministrazione orale): diminuzione della biodisponibilità della digossina.
Modalità di somministrazione e posologia
Gli aminosidi possono essere somministrati per diverse vie:
-Somministrazione per via parenterale (la più impiegata): via intramuscolare (ma con grande variabilità della velocità di assorbimento); via endovenosa per perfusioni di breve durata (30-60 minuti); quest’ultima è la via da preferire ed è indispensabile in caso di ipotensione, di trombocitopenia o di trattamento anticoagulante per via orale.
-Somministrazione locale: intrarachidea, intraventricolare, intraperitoneale, instillazioni endotracheali e per aerosol. -Somministrazione per via orale: neomicina, paromomicina, kanamicina (per la disinfezione prechirugica del tubo
gastroenterico e la prevenzione della sepsi nei soggetti aplasici). -Somministrazione per via topica e percutanea: collirio, pomata oftalmologica, ovuli ginecologici. Dato il margine terapeutico ristretto degli aminosidi e la non regolare correlazione tra dose somministrata e con-centrazioni sieriche e meningee ottenute, sarebbe auspicabile dosare i picchi sierici ed i tassi residui soprattutto nelle seguenti situazioni: -Soggetti anziani o con insufficienza renale. -In corso di gravi infezioni da bacilli Gram negativi, anche con normale funzione renale, al fine di essere sicuri di
ottenere dei tassi battericidi e di evitare dosaggi infraterapeutici o tossici. -Nei neonati e nei bambini piccoli. -Nei soggetti aventi anomala distribuzione del farmaco: obesi, soggetti disidratati, pazienti ascitici, bambini (in
questi ultimi gli aminosidi vengono eliminati più rapidamente): nei pazienti obesi il dosaggio va fatto tenendo conto del loro peso ideale e non del loro peso reale, allo scopo di evitare un sovradosaggio.
I picchi sierici auspicabili alla fine di una perfusione o 45-60 minuti dopo una iniezione per via intramuscolare sono di 6-8 µg/ml per gentamicina, tobramicina e netilmicina, e di 10-30 µg/ml per l’amikacina. I tassi residui auspicabili prima della successiva perfusione o iniezione im sono di 1-2 µg/ml per la gentamicina ed i suoi succedanei, e di 3-7 mcg/ml per l’amikacina. Per la gentamicina ed i suoi succedanei, dei picchi sierici inferiori a 4 µg/ml e dei tassi residui inferiori a 0.5 mcg/ml sono considerati infraterapeutici, nel caso di trattamento di gravi infezioni. Al contrario, sempre per la gentamicina ed i suoi succedanei, dei picchi sierici superiori a 10 µg/ml e, soprattutto, dei tassi residui superiori a 2 µg/ml sono considerati tossici. Tali valori sono in genere ottenuti con una posologia di 3-5 mg/kg/die in due iniezioni giornaliere per quanto riguarda gentamicina, tobramicina e netilmicina (per il trat-tamento delle infezioni delle vie urinarie possono bastare dosaggi di 1.5-3.0 mg/kg/die) e di 15 mg/kg/die per quanto riguarda l’amikacina. La somministrazione in perfusione endovenosa dovrà essere utilizzata soprattutto quando è controindicata la via intramuscolare (terapia anticoagulante, trombocitopenia con diatesi emorragica). L’iniezione intravenosa diretta (bolo) dovrà essere evitata, a causa del rischio di picchi sierici eccessivi, tossici, e del rischio aumentato di blocco neuromuscolare. È dibattuto se la dose giornaliera debba essere somministrata in una sola assunzione quotidiana o debba essere suddivisa in 2-3 iniezioni. La tendenza attuale è quella di preferire la monosomministrazione quotidiana nel caso di infezioni da bacilli Gram negativi (escluso Pseudomonas e Serratia) nei soggetti con meno di 65 anni e per tratta-menti inferiori a 10 giorni, a causa della concentrazione-dipendenza degli aminosidi, dell’aumento dell’effetto post-antibiotico e della diminuzione della nefrotossicità in questo tipo di somministrazione. La somministrazione unica giornaliera viene impiegata nel trattamento delle pielonefriti; tuttavia, in caso di tratta-mento di gravi infezioni sistemiche (endocarditi, infezioni da enterococco o Pseudomonas, infezioni in soggetti neutropenici), una somministrazione biquotidiana può essere preferibile. La somministrazione per instillazione endotracheale o per aerosol è stata proposta nel trattamento delle infezioni polmonari nosocomiali e della mucoviscidosi (grazie all’impiego di potenti nebulizzatori, capaci di produrre delle goccioline di piccolissimo diametro). Per via intrarachidea, si iniettano 4-8 mg/die di gentamicina (o suoi succeda-nei), saggiando i tassi residui dell’aminoside e la battericidia del liquor. Per via intraventricolare le dosi vengono somministrate tramite il reservoire di Omaya. La via intraperitoneale viene utilizzata soprattutto nei soggetti dializzati (su catetere infetto) o in caso di ascite infetta in soggetti cirrotici. La via orale viene impiegata per sopprimere la flora batterica intestinale ammoniogenetica in corso delle encefalopatie porto-cavali (neomicina, 2 g/die, in terapia prolungata). In perfusione endovenosa occorre evitare la somministrazione di un aminoside e di una beta-lattamina nello stesso liquido di perfusione, soprattutto in caso d’insufficienza renale e nel caso si tratti di una carbos-sipenicillina (le più inattivanti tra le beta-lattamine) e di tobramicina, gentamicina o sisomicina (i più inattivanti tra gli aminosidi). Per evitare l’inattivazione dell’aminoside, impiegare di preferenza l’amikacina ed una cefalosporina o una ureidopenicilina. Evitare le soluzioni a base di bicarbonato di sodio e di sali di calcio, a causa di incompatibilità fisico-chimiche. Bisogna adattare la posologia dell’aminoside alla funzione renale controllando periodicamente la creatininemia o, meglio, la clearance della creatinina. Un aumento della posologia è spesso necessario in rianimazione (aumento del volume di distribuzione), nei tossicodipendenti (aumento della clearance renale) e nei soggetti affeti da mucoviscidosi (aumento del volume di distribuzione e della clearance plasmatica degli aminosidi). Nel trattamento con gli aminosidi devono essere rispettati alcuni principi: -Il trattamento solo in casi eccezionali potrà superare le 2 settimane; oltre questo periodo, dovrà essere sostituito
da antibiotici meno tossici e più maneggevoli. -L’aminoglicoside dovrà essere nella maggior parte dei casi associato ad un secondo antibiotico, quasi sempre una beta-lattamina. -Il trattamento dovrà essere controllato dal monitoraggio dei tassi sierici ogni qual volta si tratti di una grave
infezione e di una terapia prolungata, al fine di evitare dosaggi infraterapeutici o tossici. Nel trattamento delle infezioni urinarie, le posologie giornaliere sono inferiori a quelle utilizzate nel trattamento delle infezioni sistemiche. Nei dializzati, iniettare circa 1/3–1/2 della dose usuale, dopo ogni seduta di dialisi. La durata della terapia con aminosidi deve essere in generale breve (10-14 giorni), giacché i vantaggi degli aminosidi sono evidenti soprattutto nei primi giorni di trattamento, allorquando l’inoculo batterico è elevato, e al contrario, gli effetti collaterali nefro ed ototossici si osservano soprattutto dopo i 10 giorni di trattamento. Fanno eccezione a questa regola le endocarditi da enterococco o streptococco e le granulocitopenie febbrili, nei quali la durata del trattamento è più prolungata (Tabella 4.6).
Estratti da uno Streptomyces Estratti da una Micromonospora
Streptomicina: Streptomyces griseus Neomicina: Streptomyces fradiae Kanamicina A: Streptomyces kanamyceticus Paromomicina: Streptomyces rimosus Amikacina: semisintesi a partire dalla kanamicina A Tobramicina: Streptomyces tenebrarius (analogo 3-desossi della kanamicina B) Dibekacina: semisintesi: 3’-4’-didesossikanamicina B Spectinomicina: Streptomyces spectabilis Trospectinomicina: semisintesi a partire dalla spectinomicina
Gentamicina: Micromonospora purpurea Isepamicina: semisintesi dalla gentamicina B Sagamicina: Micromonospora sagamiensis Sisomicina: Micromonospora inyoensis (apparentata alla gentamicina B) Netilmicina: semisintesi dalla sisomicina (derivato N-etil) Astromicina (fortimicina): Micromonospora olivoasterospora Dactinomicina: Dactylosporangium natsuzakienzae
| Formula chimica | Denominazione comune internazionale | Origine naturalo sintetica (S) | e (N) Somministrazione sistemica (S) o locale (L) |
|---|---|---|---|
| Streptomicina | Streptomicina | N | S |
| Desossistreptamine sostituite in 4-5 | Neomicina-framicetina Paromomicina | N N | L L |
| Desossistreptamine sostituite in 4-6 | Kanamicina Amikacina Tobramicina Gentamicina Netilmicina Isepamicina | N S N N S S | L S S S S S |
| Fortinomicine | Astromicina Dactinomicina | N N | S S |
| Aminociclitoli “puri” | Spectinomicina Trospectinomicina | N S | S S |
| KMA | KMB | AK | GMi | TM | SMi | NMi | NM | ||
|---|---|---|---|---|---|---|---|---|---|
| APH(3’) | 1 | + | + | - | - | - | - | - | + |
| APH(3’) | 2 | + | + | - | - | - | - | - | + |
| APH(2’) | + | + | + | + | (+) | ||||
| APH(5’) | - | - | - | - | - | - | - | + | |
| AAC(2’) | 1 | + | + | + | + | + | + | ||
| AAC(2’) | 2 | + | + | + | + | ||||
| AAC(3) | 1 | + | - | + | (+) | + | (+) | - | |
| 2 | + | + | - | + | + | + | (+) | + | |
| 3 | + | + | + | + | + | (+) | + | ||
| AAC(6’) | 1 | + | + | + | (+) | + | (+) | (+) | - |
| 2 | + | + | + | + | + | + | - | ||
| 3 | + | + | + | + | |||||
| 4 | + | + | + | + | |||||
| ANT(4’) | + | + | + | + | |||||
| ANT(2’’) | + | + | + | + | + | + | + | ||
APH: aminoglicoside fosfotransferasi; AAC: aminoglicoside acetiltransferasi; ANT: aminoglicoside nucleotidiltransferasi; KMA: kanamicina A; KMB: kanamicina B; AK: amikacina; GMi: gentamicina; TM: tobramicina; SMi: sisomicina; NMi: netilmicina; NM: neomicina.
Altri anti-infettivi Antibiotico o altri farmaci Tipo di effetto Meccanismo Indicazioni principali
Aminoglicosidi Beta-lattamine: Aminopenicilline
Aztreonam
Penicilline e cefalosporine antistafilococciche
Penicilline e cefalosporine anti- Pseudomonas
Penicillina G
Carbapenemi (imipenem, meropenem)
Acido fusidico
Clindamicina
Sinergia antibatterica + superamento delle resistenze batteriche
Sinergia antibatterica + superamento delle resistenze batteriche + ampliamento dello spettro antibatterico dell’aztreonam
Sinergia antibatterica + superamento delle resistenze batteriche
Sinergia antibatterica + superamento delle resistenze batteriche
Sinergia antibatterica + superamento delle resistenze batteriche
Sinergia antibatterica + superamento delle resistenze batteriche
Sinergia antibatterica + superamento delle resistenze batteriche
Sinergia antibatterica + superamento delle resistenze batteriche + ampliamento dello spettro antibatterico La beta-lattamina aumenta la permeabilità della parete batterica, permettendo all’aminoglicoside di accedere ai suoi bersagli d’azione batterici + aumento della battericidia + allungamento dell’effetto post-antibiotico ed inibizione delle ricrescite tardive
Azione antibatterica sulla sintesi delle proteine batteriche a due livelli: subunità 30 S (aminosidi) e 50 S (acido fusidico) dei ribosomi batterici
Azione antibatterica sulla sintesi delle proteine batteriche a due livelli: subunità 30 S e 50 S dei ribosomi batterici
Enterobatteri, enterococchi, Listeria
Enterobatteri, Pseudomonas
Stafilococchi
Enterobatteri, Pseudomonas, Acinetobacter
Streptococchi, enterococchi (endocarditi)
Enterobatteri, Pseudomonas, stafilococchi, enterococchi
Stafilococchi meticillino-resistenti
Stafilococchi, infezioni miste da aerobi-anaerobi
| Altri anti-infettivi | ||||
| Antibiotico | o altri farmaci | Tipo di effetto | Meccanismo | Indicazioni principali |
| Streptogramine | Sinergia antibatterica + superamento delle resistenze batteriche | Inibizione della sintesi proteica batterica: subunità ribosomali 50 S | Stafilococchi meticillino-resistenti | |
| (streptogramine) e 30 S (aminosidi) | ||||
| Trimethoprim e cotrimossazolo | Sinergia antibatterica + superamento delle resistenze batteriche | Inibizione della sintesi proteica batterica (aminosidi); inibizione della sintesi di acido folinico | Stafilococchi, enterobatteri | |
| (trimethoprim) | ||||
| Alcalinizzanti urinari | Creazione di un pH ottimale per gli aminosidi (ma diminuzione dell’eliminazione urinaria degli amnosidi) | Infezioni urinarie (enterobatteri) | ||
| Calcioantagonisti | Possibile diminuzione della nefrotossicità degli aminosidi (sperimentale) | ? | Associazione proposta su basi sperimentali | |
| Streptomicina | Tetracicline (doxiciclina) | Sinergia antibatterica + superamento delle resistenze batteriche | Inibizione congiunta della sintesi proteica batterica (subunità ribosomali 30 S) | Brucella (streptomicina + tetraciclina) |
| Amikacina, streptomicina | Antimicobatterici etambutolo, isoniazide, claritromicina, minociclina, clofazimina, rifampicina, rifabutina | Sinergia antibatterica + superamento delle resistenze batteriche | Mycobacterium avium | |
| Paromomicina | Composti antimoniali pentavalenti | Sinergia | Azione congiunta anti-Leishmania | Leishmania |
| Antibiotico | Altri anti-infettivi o altri farmaci | Tipo di rischio | Fattori favorenti | Meccanismo | Mezzi di prevenzione o correzione | Comportamento da adottare |
|---|---|---|---|---|---|---|
| Aminoglicosidi in generale | Amfotericina B | Aumentato rischio di nefrotossicità, ipokalemia, ipocalcemia ed ipomagnesiemia | Trattamenti prolungati | Potenziamento delle rispettive nefrotossicità | Monitoraggio della creatininemia, ECG, dosaggio dei tassi plasmatici degli antibiotici, correzione degli elettroliti | Associazione da usare con precauzione |
| AciclovirIv | Aumentato rischio di nefrotossicità | Trattamenti prolungati, dosi elevate, disidratazione | Addizione delle rispettive nefrotossicità | Monitoraggio della creatininemia | Associazione da usare con precauzione | |
| Beta-lattamine nefrotossiche: cefaloridina, meticillina, cefalotina ? | Aumentato rischio di nefrotossicità | Dosi elevate, insufficienza renale preesistente | Addizione delle rispettive nefrotossicità | Monitoraggio della creatininemia | Associazione controindicata (ricorrere ad altre beta-lattamine) | |
| Foscarnet | Aumentato rischio di nefrotossicità | Trattamenti prolungati | Addizione delle rispettive nefrotossicità | Monitoraggio della creatininemia | Associazione da usare con precauzione | |
| Fosfomicina iv | Aumentato rischio di ipokalemia, di disturbi del ritmo (ma, forse, diminuita | Dosi elevate, trattamenti prolungati | Addizione dei rispettivi effetti ipokalemizzanti | Monitoraggio potassiemia e creatininemia | Associazione da usare con precauzione | |
| nefrotossicità | ||||||
| dell’aminoglicoside) | ||||||
| 5 fluorocitosina | Aumentato rischio di nefrotossicità, rischio di sovradosaggio della flucitosina | Dosi elevate, trattamenti prolungati | Addizione delle rispettive nefrotossicità + competizione sull’eliminazione- | Monitoraggio della creatininemia e dei tassi plasmatici dei due antibiotici | Associazione da usare con precauzione | |
| filtrazione glomerulare | ||||||
| Pentamidina iv | Aumentato rischio di nefrotossicità | Dosi elevate | Addizione delle rispettive nefrotossicità | Monitoraggio della creatininemia | Associazione da usare con precauzione | |
| Polimixina-colistina (via parenterale) | Rischio molto aumentato di nefrotossicità | Dosi elevate | Netto potenziamento delle rispettive nefrotossicità | Monitoraggio della creatininemia | Associazione fortemente sconsigliata (continua) |
torna su vai all'Home Page vai all'indice antibioticoterapia Tipo di
Altri anti-infettivi Mezzi di prevenzione
rischio Fattori favorenti Meccanismo o correzione da adottare
| Vancomicina ev | Aumentato rischio di | Dosi elevate, trattamenti | Addizione delle | Monitoraggio della | Associazione da usare con | |
|---|---|---|---|---|---|---|
| nefrotossicità | prolungati | rispettive nefrotossicità | creatininemia ed | precauzione | ||
| audiogramma | ||||||
| Beta-lattamine in | Rischio d’inattivazione | Penicilline; dosi molto | Iniettare separatamente i | Associazione da valutare | ||
| perfusione iv lenta | diretta dell’aminoside | elevate perfusioni di | due antibiotici; scegliere | |||
| da parte della beta | lunga durata | gli aminosidi più stabili | ||||
| lattamina | all’inattivazione (amikacina, | |||||
| netilmicina) e le beta | ||||||
| lattamine meno inattivanti | ||||||
| (ureidopenicilline, | ||||||
| cefalosporine) | ||||||
| Neomicina | Penicillina V | Diminuzione | Trattamenti prolungati | Malassorbimento | Adattamento della | Associazione da valutare |
| dell’assorbimento e dei | digestivo | posologia della penicillina | ||||
| tassi plasmatici della | ||||||
| penicillina | ||||||
| Neomicina, | Rallentanti lo | Aumento | Rispettare un intervallo di | Associazione da valutare | ||
| Paromomicina | svuotamento | dell’assorbimento | molte ore tra le assunzioni | |||
| (via orale) | gastroenterico | gastroenterico degli | dei due farmaci | |||
| aminosidi; rischio di | ||||||
| nefrotossicità | ||||||
| Antinfiammatori non | Aumentato rischio di | Trattamenti prolungati, | Effetto anti- | Monitoraggio della | Associazione da usare con | |
| steroidei | nefrotossicità | insufficienza renale | prostaglandine a livello | creatininemia | precauzione | |
| (FANS) | preesistente | renale | ||||
| Aminoglicosidi | Agenti curarizzanti, | Rischio di blocco | Via parenterale o | Blocco pre e post- | Ventilazione assistita, | Sorvegliare il grado di |
| in generale | sali di Mg | neuromuscolare | intraperitoneale; | sinaptico | somministrazione di | curarizzazione al termine |
| (potenziamento dei | bambini inferiori a | neostigmina e calcio | dell’anestesia | |||
| curarici) | 2 anni | |||||
| Ciclosporina, | Aumentato rischio di | Trattamenti prolungati | Incremento delle | Monitoraggio creatininemia | Associazione da usare con | |
| tacrolimus | nefrotossicità | rispettive nefrotossicità | e tassi plasmatici di | precauzione | ||
| ciclosporina | ||||||
180
torna su vai all'Home Page vai all'indice antibioticoterapia
| Antibiotico | Altri anti-infettivi o altri farmaci | Tipo di rischio | Fattori favorenti | Meccanismo | Mezzi di prevenzione o correzione | Comportamento da adottare |
|---|---|---|---|---|---|---|
| Cisplatino, carboplatino, daunorubicina | Aumentato rischio di nefrotossicità ed ototossicità | Insufficienza renale | Incremento delle rispettive tossicità | Monitoraggio creatininemia ed audiogramma | Associazione sconsigliata | |
| Diuretici dell’ansa (furosemide, bumetanide) | Aumentato rischio di nefrotossicità ed ototossicità | Insufficienza renale | Sommazione delle rispettive nefro ed ototossicità | Idratazione; monitoraggio creatininemia; audiogramma | Associazione da usare con precauzione | |
| ACE inibitori | Aumentato rischio di nefrotossicità | Insufficienza renale preesisente | Sommazione delle rispettive nefrotossicità | Monitoraggio creatininemia, potassiemia | Associazione da usare con precauzione | |
| Metossiflurano | Aumentato rischio di nefrotossicità | Sommazione delle rispettive nefrotossicità | Monitoraggio creatininemia | Associazione da usare con precauzione | ||
| Mezzi di contrasto iodati | Aumentato rischio di nefrotossicità | Insufficienza renale | Sommazione delle rispettive nefrotossicità | Idratazione, monitoraggio creatininemia; effettuare esami radiologici con mezzo di contrasto solo se | Associazione da usare con precauzione | |
| effettivamente | ||||||
| necessari | ||||||
| Tossina botulinica* | Aumentato rischio di apnea e di disturbi respiratori da parte della tossina | Insufficienza renale, sovradosaggio | Sommazione delle rispettive tossicità | Impiegare un altro antibiotico | Associazione sconsigliata |
* Impiegata nel trattamento del torcicollo spastico, in oftalmologia (blefarospasmo) ed in gastroenterologia (acalasia esofagea, spasmi esofagei).
AMINOGLICOSIDI E AMINOCICLITOLI 181
| Aminoside | Forme farmaceutiche | Modalità di somministrazione e posologia |
|---|---|---|
| Streptomicina | f 1.000.000 U.I. f 1 g polv. 1 g | Adulto: 1.000.000-2.000.000 U.I./die ogni 3 giorni |
| Kanamicina | f 1 g im | Fiale im 15 mg/kg/die suddivisi in 2-4 somministrazioni |
| Gentamicina | f 10 mg im/iv f 20 mg im/iv f 40 mg im/iv f 80 mg im/iv f 120 mg im/iv f 160 mg im/iv Crema 0,1% Ung. 0,1% Coll. 0,3% Coll. 0,5% Pom. oft. 0,3% Pom. oft. 0,5% | Fiale im/iv. Adulti infezioni sistemiche: 3 mg/kg/die suddivisi in 3 somministrazioni. Adulti infezioni urinarie: 2 mg/kg/die suddivisi in 2 somministrazioni via endovenosa ed intraventricolare. Adulti: 4-8 mg/die Crema, unguento. 1-4 medicazioni al giorno Collirio: 1-2 gtt 3-6 volte al dì. Pomata oftalmica: applicazione 2 volte al giorno. |
| Tobramicina | oto gtt 3% Coll. 0,3% Pom. oft. 0,3% Sir. 100 mg Sir. 150 mg f 100 mg im/iv f 150 mg im/iv f 20 mg im/iv f 40 mg im/iv | Collirio: 1-2 gtt 4-5 volte al dì. Pomata oftalmica: 1 cm di pomata 3-4 volte al dì. Gocce otologiche: 4 gtt 3 volte al dì. Fiale im/iv Adulti: 1-3 mg/kg ogni 8 ore. |
| Netilmicina | f 15 im/iv f 50 mg im/iv f 100 mg im/iv f 150 mg im/iv f 200 mg im/iv f 300 mg im/iv Coll. 0,3% | Fiale im/iv: 4-6 mg/kg/die suddivisi in 1-3 somministrazioni. Collirio: 1-2 gtt 3 volte al dì. |
| Paromomicina | cps 250 mg scir. 2,5% | Adulti: 20-30 mg/kg/die in dosi regolarmente ripartite s.p.m. |
| Spectinomicina | f 2 g im | Bambini: 30-50 mg/kg/die in dosi regolarmente ripartite s.p.m. |
| Isepamicina | f 250 im/iv f 500 im/iv | Fiale im 2-4 g/die |